CHAPITRE 14: Item 84 Glaucomes
Pr F. Aptel, Visis et Médipôle Elsan, Perpignan
Pr J.-F. Rouland, CHU de Lille
Situations cliniques de départ
Le glaucome peut être évoqué dans les situations cliniques suivantes.
 27 – Chute de la personne âgée : l’altération de la vision – notamment la perte du champ visuel périphérique – augmente le risque de chute chez les personnes âgées atteintes de glaucome.
27 – Chute de la personne âgée : l’altération de la vision – notamment la perte du champ visuel périphérique – augmente le risque de chute chez les personnes âgées atteintes de glaucome.
 138 – Anomalie de la vision : le glaucome est une maladie initialement peu sympto-matique dans la grande majorité des cas; la réduction du champ visuel périphérique puis central est tardive.
138 – Anomalie de la vision : le glaucome est une maladie initialement peu sympto-matique dans la grande majorité des cas; la réduction du champ visuel périphérique puis central est tardive.
 152 – œil rouge et/ou douloureux : certaines formes des glaucomes – notamment la typique crise aiguë de fermeture de l’angle – peuvent se manifester par des douleurs oculaires et une rougeur oculaire, alors que le glaucome primitif à angle ouvert est indolore et sans modification de l’aspect externe de l’œil.
152 – œil rouge et/ou douloureux : certaines formes des glaucomes – notamment la typique crise aiguë de fermeture de l’angle – peuvent se manifester par des douleurs oculaires et une rougeur oculaire, alors que le glaucome primitif à angle ouvert est indolore et sans modification de l’aspect externe de l’œil.
 178 – Demande/prescription raisonnée et choix d’un examen diagnostique; 230 – Rédaction de la demande d’un examen d’imagerie; 231 – Demande d’un examen d’imagerie : le diagnostic et le suivi du glaucome reposent à la fois sur une étude de la structure du nerf optique (examen de la papille optique au fond d’œil, et OCT de la papille et des fibres optiques péripapillaires) et de sa fonction (examen du champ visuel).
178 – Demande/prescription raisonnée et choix d’un examen diagnostique; 230 – Rédaction de la demande d’un examen d’imagerie; 231 – Demande d’un examen d’imagerie : le diagnostic et le suivi du glaucome reposent à la fois sur une étude de la structure du nerf optique (examen de la papille optique au fond d’œil, et OCT de la papille et des fibres optiques péripapillaires) et de sa fonction (examen du champ visuel).
 232 – Demande d’explication d’un patient sur le déroulement, les risques et les bénéfices attendus d’un examen d’imagerie : les différents examens nécessaires au diagnostic et au suivi d’un glaucome nécessitent une coopération optimale du patient, notamment l’étude du champ visuel, et leurs principes, objectifs et déroulement doivent donc être expliqués au préalable.
232 – Demande d’explication d’un patient sur le déroulement, les risques et les bénéfices attendus d’un examen d’imagerie : les différents examens nécessaires au diagnostic et au suivi d’un glaucome nécessitent une coopération optimale du patient, notamment l’étude du champ visuel, et leurs principes, objectifs et déroulement doivent donc être expliqués au préalable.
 316 – Identifier les conséquences d’une pathologie/situation sur le maintien d’un emploi : la perte du champ visuel et/ou la baisse d’acuité visuelle peuvent contre-indiquer l’exercice de certaines professions; dans des situations particulières une collaboration avec le médecin du travail est nécessaire.
316 – Identifier les conséquences d’une pathologie/situation sur le maintien d’un emploi : la perte du champ visuel et/ou la baisse d’acuité visuelle peuvent contre-indiquer l’exercice de certaines professions; dans des situations particulières une collaboration avec le médecin du travail est nécessaire.
 328 – Annonce d’une maladie chronique : le glaucome est une pathologie potentiellement cécitante. L’annonce du diagnostic doit donc être prudente, et accompagnée d’explications, notamment sur la possibilité de contrôler l’évolution de la grande majorité des glaucomes avec un simple traitement médical sous forme de collyres.
328 – Annonce d’une maladie chronique : le glaucome est une pathologie potentiellement cécitante. L’annonce du diagnostic doit donc être prudente, et accompagnée d’explications, notamment sur la possibilité de contrôler l’évolution de la grande majorité des glaucomes avec un simple traitement médical sous forme de collyres.
 330 – Bêta-bloq uants : connaître les mécanismes d’action, indications, effets secondaires interactions médicamenteuses, modalités de surveillance des collyres bêta-bloquants.
330 – Bêta-bloq uants : connaître les mécanismes d’action, indications, effets secondaires interactions médicamenteuses, modalités de surveillance des collyres bêta-bloquants.
 250345 – Situation de handicap : le glaucome peut parfois aboutir à une situation de malvoyance ou de cécité, et dans ce cas des démarches de reconnaissance et de prise en charge du handicap doivent être entreprises.
250345 – Situation de handicap : le glaucome peut parfois aboutir à une situation de malvoyance ou de cécité, et dans ce cas des démarches de reconnaissance et de prise en charge du handicap doivent être entreprises.
 352 – Expliquer un traitement au patient (adulte/enfant/adolescent) : le traitement du glaucome est la plupart du temps un traitement médical sous forme de collyres pris à vie; le patient doit avoir bien compris les objectifs du traitement, les méthodes d’instillation des collyres et les potentiels effets secondaires, de façon à optimiser l’observance du traitement.
352 – Expliquer un traitement au patient (adulte/enfant/adolescent) : le traitement du glaucome est la plupart du temps un traitement médical sous forme de collyres pris à vie; le patient doit avoir bien compris les objectifs du traitement, les méthodes d’instillation des collyres et les potentiels effets secondaires, de façon à optimiser l’observance du traitement.
Hiérarchisation des connaissances
| Rang | Rubrique | Intitulé et descriptif |
|
|
Identifier une urgence | Savoir qu’une crise aiguë de fermeture de l’angle est une urgence menaçant le pronostic visuel |
|
|
Identifier une urgence | Connaître les facteurs de risque et les facteurs déclenchants d’une crise aiguë de fermeture de l’angle |
|
|
Prévalence, épidémiologie | Importance du dépistage du glaucome primitif à angle ouvert à 40 ans |
|
|
Physiopathologie | Savoir que le glaucome primitif à angle ouvert est une perte accélérée des fibres optiques et apoptose |
|
|
Définition | Définition du glaucome primitif à angle ouvert |
|
|
Définition | Facteurs de risque du glaucome primitif à angle ouvert |
|
|
Diagnostic positif | Connaître les signes d’une crise aiguë de fermeture de l’angle |
|
|
Diagnostic positif | Connaître les principes de mesure de la pression intraoculaire (PIO) |
|
|
Diagnostic positif | Connaître les deux formes cliniques de glaucome primitif à angle ouvert : à PIO élevée et PIO normale |
|
|
Diagnostic positif | Connaître les principales caractéristiques de l’atteinte du glaucome primitif à angle ouvert : structure et fonction |
|
|
Diagnostic positif | Connaître les diagnostics différentiels du glaucome primitif à angle ouvert |
|
|
Diagnostic positif | Les signes diagnostiques de glaucome primitif à angle ouvert sur le champ visuel |
|
|
Prise en charge | Connaître la prise en charge en urgence d’une crise aiguë de fermeture de l’angle |
|
|
Prise en charge | Savoir que le traitement du glaucome primitif à angle ouvert est la réduction de la PIO |
|
|
Prise en charge | Connaître les différentes classes thérapeutiques d’antihypertenseurs oculaires, leurs contre-indications et effets secondaires |
|
|
Prise en charge | Connaître les mécanismes d’action des traitements médicaux |
|
|
Prise en charge | Connaître les principes du traitement non pharmacologique |
|
|
Connaître les mécanismes d’action | Bêta-bloquants : connaître les mécanismes d’action, indications, effets secondaires interactions médicamenteuses, modalités de surveillance et principales causes d’échec |
I 252253Introduction
![]() Le glaucome est une neuropathie optique d’évolution progressive constituée par une apop-tose accélérée des cellules constituant le nerf optique, les cellules ganglionnaires rétiniennes, se traduisant structurellement par des anomalies caractéristiques de la papille optique et fonc-tionnellement par des altérations du champ visuel pouvant aboutir, à un stade tardif, à la cécité. Il existe de nombreuses classifications des différentes formes de glaucomes, en fonction :
Le glaucome est une neuropathie optique d’évolution progressive constituée par une apop-tose accélérée des cellules constituant le nerf optique, les cellules ganglionnaires rétiniennes, se traduisant structurellement par des anomalies caractéristiques de la papille optique et fonc-tionnellement par des altérations du champ visuel pouvant aboutir, à un stade tardif, à la cécité. Il existe de nombreuses classifications des différentes formes de glaucomes, en fonction :
- • de l’état anatomique de l’angle iridocornéen (glaucome à angle ouvert lorsque l’angle formé par l’iris et la cornée est large et permet facilement l’accès de l’humeur aqueuse au trabé-culum, ou glaucome par fermeture de l’angle lorsque l’iris a tendance à s’apposer contre le trabéculum et la cornée, et à empêcher l’accès de l’humeur aqueuse au trabéculum);
- • de l’étiologie du glaucome (glaucome primitif en l’absence d’anomalies oculaires ou générales associées, ou secondaire à une autre pathologie oculaire ou générale), etc.
Le glaucome primitif à angle ouvert est la forme la plus fréquente des glaucomes en Occident et en Afrique, et sera détaillé en premier dans ce chapitre.
II Glaucome primitif à angle ouvert
![]() Le terme de glaucome primitif à angle ouvert (GPAO), ou primary open-angle glaucoma (POAG) en anglais, est mondialement utilisé et remplace l’ancienne dénomination de glaucome chronique.
Le terme de glaucome primitif à angle ouvert (GPAO), ou primary open-angle glaucoma (POAG) en anglais, est mondialement utilisé et remplace l’ancienne dénomination de glaucome chronique.
Il se définit comme une neuropathie optique progressive avec des altérations caractéristiques de la tête du nerf optique (atteinte de la structure) et des altérations correspondantes du champ visuel (atteinte de la fonction), en présence d’un angle iridocornéen ouvert. C’est une maladie initialement peu ou pas symptomatique et d’évolution lente, ce qui fait sa gravité.
B Épidémiologie
![]() Le glaucome est la deuxième cause de cécité dans le monde.
Le glaucome est la deuxième cause de cécité dans le monde.
La prévalence du GPAO augmente avec l’âge, et est d’environ 0,5 % à 1 % d’une population adulte de plus de 40 ans en Europe et en Amérique du Nord, soit, en France, environ 1,2 à 1,5 million.
Le glaucome constitue la deuxième cause de cécité dans les pays occidentaux après la dégénérescence maculaire liée à l’âge (DMLA) et la première cause de cécité irréversible.
C Physiopathologie
![]() Le GPAO est caractérisé par une accélération de la vitesse d’apoptose des cellules ganglionnaires rétiniennes, et est donc considéré comme étant une maladie neurodégénérative. Les cellules ganglionnaires de la rétine (environ 1 million pour chaque œil) conduisent les informations visuelles recueillies au niveau des photorécepteurs de la rétine, depuis les cellules bipolaires jusqu’au corps genouillé latéral. Après 40 ans, le simple fait de vieillir entraîne la perte d’environ 5 000 à 8 000 cellules ganglionnaires par an. Le GPAO est en fait la perte accélérée de ces fibres optiques par rapport à la perte physiologique liée à l’âge.
Le GPAO est caractérisé par une accélération de la vitesse d’apoptose des cellules ganglionnaires rétiniennes, et est donc considéré comme étant une maladie neurodégénérative. Les cellules ganglionnaires de la rétine (environ 1 million pour chaque œil) conduisent les informations visuelles recueillies au niveau des photorécepteurs de la rétine, depuis les cellules bipolaires jusqu’au corps genouillé latéral. Après 40 ans, le simple fait de vieillir entraîne la perte d’environ 5 000 à 8 000 cellules ganglionnaires par an. Le GPAO est en fait la perte accélérée de ces fibres optiques par rapport à la perte physiologique liée à l’âge.
254![]() De nombreux facteurs associés à un risque élevé d’apparition d’un glaucome ont été clairement identifiés :
De nombreux facteurs associés à un risque élevé d’apparition d’un glaucome ont été clairement identifiés :
- • l’âge : la prévalence du GPAO est de moins de 0,5 % entre 40 et 50 ans pour atteindre environ 10 % après 85 ans;
- • l’hypertonie oculaire : l’augmentation de la pression intraoculaire (PIO) au-delà de deux écarts types (2,5 mmHg par écart type) de la valeur statistiquement normale (15,5 mmHg) est un facteur de risque mais pas la cause du GPAO;
- • les antécédents familiaux : les antécédents familiaux directs confèrent un risque 3 fois plus élevé de développer un GPAO pour les descendants. Des gènes ont été identifiés mais leur recherche n’a pas d’application clinique pour le moment;
- • l’ethnicité : les patients mélanodermes, essentiellement d’origine africaine, ont un risque 3 fois plus élevé de développer un GPAO que les autres ethnies;
- • la myopie : la myopie forte multiplie par trois le risque de développer un GPAO.
![]() D’autres facteurs de risque comme le diabète et les maladies cardiovasculaires sont décrits, mais beaucoup moins bien étayés que ceux retenus ci-dessus.
D’autres facteurs de risque comme le diabète et les maladies cardiovasculaires sont décrits, mais beaucoup moins bien étayés que ceux retenus ci-dessus.
D Circonstances de découverte
![]() Les circonstances de découverte sont variables. On retiendra principalement :
Les circonstances de découverte sont variables. On retiendra principalement :
- • une découverte fortuite à l’occasion d’un examen ophtalmologique de routine. Une PIO supérieure à 21 mmHg (vidéo 14.1
 ) ou une anomalie de la papille optique, essentiellement une grande excavation, attirent l’attention de l’ophtalmologiste qui pratique alors un bilan avec un champ visuel et un OCT;
) ou une anomalie de la papille optique, essentiellement une grande excavation, attirent l’attention de l’ophtalmologiste qui pratique alors un bilan avec un champ visuel et un OCT; - • une découverte à l’occasion d’un examen demandé par un patient qui a des antécédents familiaux de glaucome;
- • une découverte à l’occasion d’une complication. Le GPAO connaît deux complications majeures :
![]() En cas de GPAO, l’aspect externe de l’œil n’est pas modifié (pas de rougeur oculaire) et l’œil n’est pas douloureux.
En cas de GPAO, l’aspect externe de l’œil n’est pas modifié (pas de rougeur oculaire) et l’œil n’est pas douloureux.
E Diagnostic
![]() Un examen ophtalmologique complet, complété d’examens complémentaires, confirme le diagnostic du GPAO et établit sa sévérité.
Un examen ophtalmologique complet, complété d’examens complémentaires, confirme le diagnostic du GPAO et établit sa sévérité.
L’acuité visuelle n’est pas affectée, sauf dans les stades tardifs de la maladie ou en cas d’autre pathologie oculaire associée (cataracte, DMLA). L’œil est calme, blanc, non douloureux. À l’examen à la lampe à fente, la chambre antérieure est profonde et la motilité pupillaire normale, sauf au stade tardif de la maladie où un déficit pupillaire afférent relatif est observé. L’examen de l’angle iridocornéen, appelé examen gonioscopique ou encore gonioscopie, montre par définition un angle ouvert, c’est-à-dire une visibilité du trabéculum pigmenté (le filtre où se draine l’humeur aqueuse) de plus de 180° de la circonférence de l’angle. L’épaisseur et la rigidité cornéennes sont estimées afin d’interpréter la mesure par aplanation cornéenne de la PIO.
La PIO est généralement élevée (70 % à 80 % des cas de GPAO en Occident), mais parfois dans les limites de la normale. On parle dans ce cas de glaucome à pression normale.
255L’examen va mettre en évidence des anomalies de la structure et/ou de la fonction :
- • anomalies de la structure visibles cliniquement : il s’agit des anomalies de la papille optique, structure anatomique bien visible lors de l’examen du fond d’œil et qui correspond à la coudure à 90° des axones des cellules ganglionnaires avant de quitter le globe oculaire par le canal scléral. Ces anomalies sont essentiellement une diminution de la surface de l’anneau neurorétinien diffuse ou localisée, des hémorragies parapapillaires en flammèches et une atrophie parapapillaire de type bêta. L’augmentation de l’excavation papillaire accompagne la perte de l’anneau neurorétinien (fig. 14.2 à fig. 14.7). Elle s’exprime par rapport à la taille de la papille optique (cup/disc ratio). Une asymétrie de ce ratio supérieure à 0,2 entre les deux yeux est suspecte de glaucome;

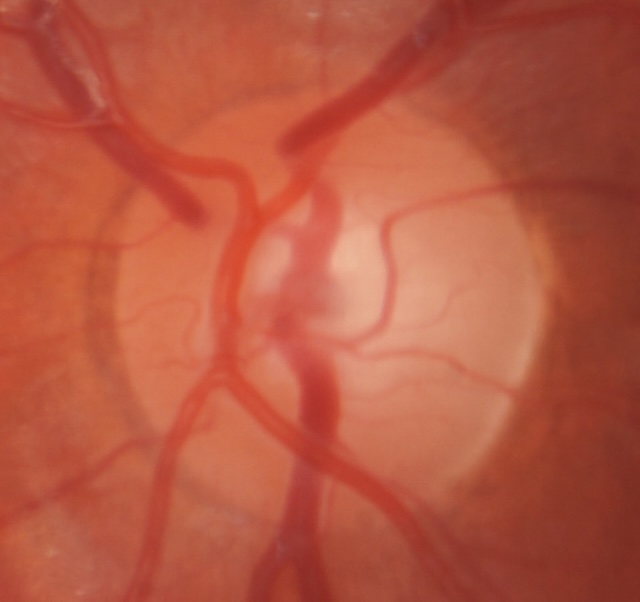
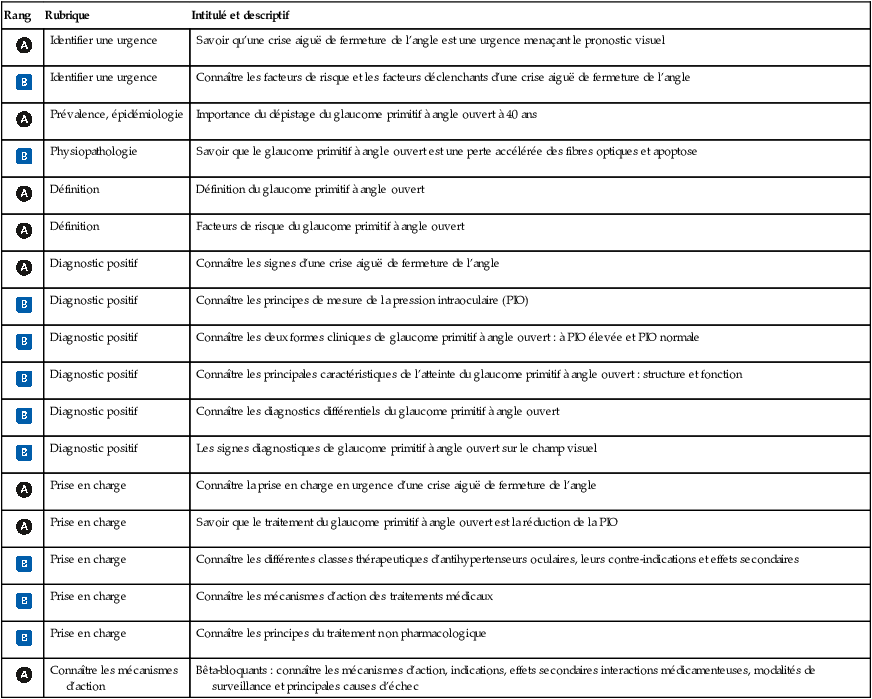
Fig. 14.2 Papille optique normale.
L’anneau neurorétinien est bien charnu et l’excavation papillaire < 5/10.Sur cette image en fond d’œil, on observe une papille optique de morphologie normale. Les contours sont nets et réguliers, sans signe d’œdème ou d’excavation pathologique. L’excavation physiologique est présente au centre, de taille modérée, bien centrée, et entourée par un anneau neuro-rétinien de coloration rosée uniforme. Les vaisseaux rétiniens émergent de façon symétrique, sans déviation ni amincissement anormal. Aucune hémorragie péripapillaire, atrophie ou anomalie vasculaire n’est visible. Cet aspect est en faveur d’un nerf optique sain, sans atteinte glaucomateuse ni autre pathologie manifeste.

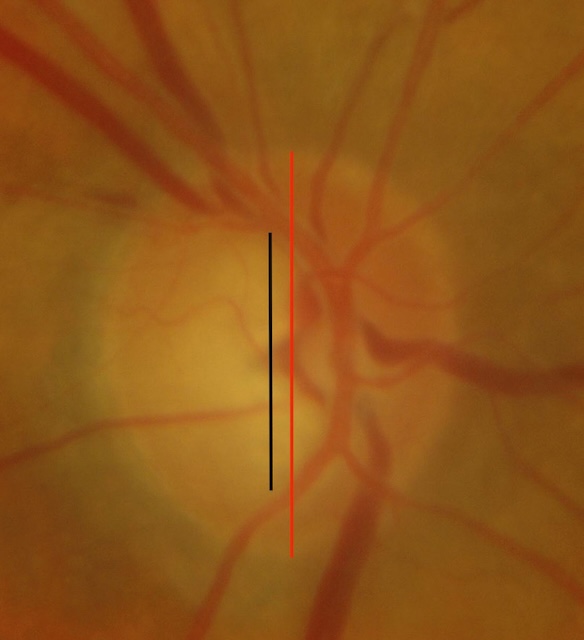
Fig. 14.3 Excavation papillaire glaucomateuse (augmentation du rapport cup/disc).
Il existe une dépression (cup) excessive par rapport à la taille de la papille (disc). Le trait noir correspond au diamètre vertical de l’excavation (cup) et le trait rouge au diamètre vertical de la papille (disc).Sur cette photographie du fond d’œil, on distingue une excavation papillaire anormalement élargie, traduisant une atteinte glaucomateuse. Le rapport cup/disc est nettement augmenté, comme l’indique la comparaison entre la ligne noire (excavation) et la ligne rouge (diamètre total de la papille). L’anneau neuro-rétinien semble aminci, notamment en inférieur, avec une perte de substance marquée. La périphérie de la papille reste relativement bien délimitée, mais l’excavation centrale, pâle, occupe une grande portion du disque optique. Cet aspect est typique d’une neuropathie optique glaucomateuse.

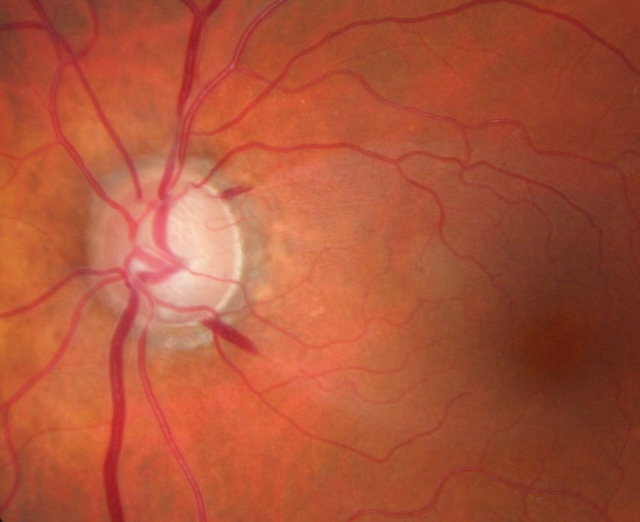
Fig. 14.4 Hémorragie parapapillaire en flammèche et atrophie parapillaire bêta. La photographie couleur du fond d’œil met en évidence une hémorragie en flammèche en supérieur de la papille optique, orientée selon le trajet des fibres nerveuses. Cette hémorragie fine et superficielle est un signe d’alerte fréquent dans le glaucome à angle ouvert. On observe également une zone d’atrophie parapapillaire bêta nasale, marquée par une dépigmentation du tissu rétinien et une visibilité accrue des vaisseaux choroïdiens sous-jacents. La papille présente un rapport cup/disc augmenté avec un amincissement de l’anneau neuro-rétinien. L’ensemble évoque une neuropathie optique glaucomateuse évolutive.

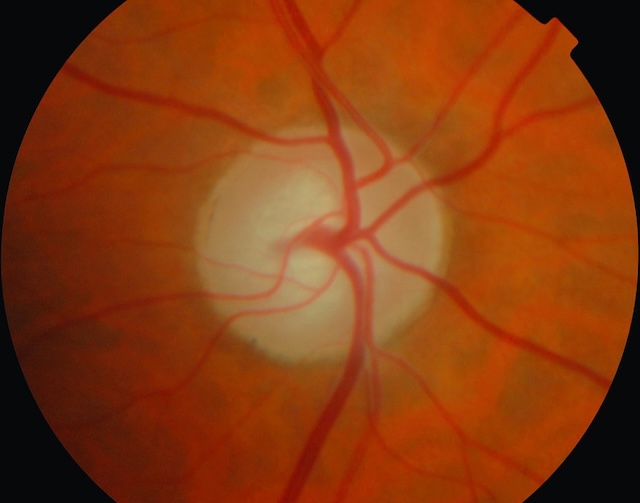
Fig. 14.5 Excavation papillaire modérée. La photographie du fond d’œil révèle une papille optique présentant une excavation centrale bien délimitée, de taille modérément augmentée. Le rapport cup/disc semble approximativement supérieur à 0,5, ce qui oriente vers une excavation papillaire modérée. Le contour du bord neuro-rétinien reste relativement préservé, sans encoche évidente ni amincissement asymétrique. Les vaisseaux émergeant du centre de la papille suivent un trajet radial régulier. L’ensemble de ces éléments suggère une surveillance étroite chez un patient à risque, sans signe manifeste de neuropathie optique évolutive à ce stade.

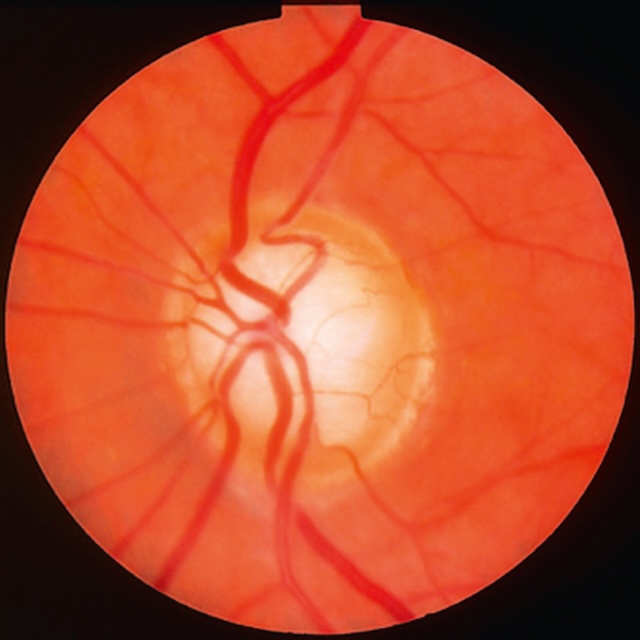
Fig. 14.6 Excavation papillaire évoluée. L’image montre une excavation papillaire nettement augmentée, traduisant une atteinte glaucomateuse avancée. La cupule occupe quasiment toute la surface de la papille, avec un amincissement marqué du bord neuro-rétinien, surtout en inférieur. Les vaisseaux rétiniens sont déviés en périphérie, s’insérant aux extrémités du disque. Cette architecture est caractéristique d’un glaucome à un stade évolué, avec perte axonale importante. Aucun signe d’œdème, d’hémorragie ni d’anomalie pigmentaire visible. Le fond rétinien est bien visible, confirmant l’absence de trouble des milieux oculaires.

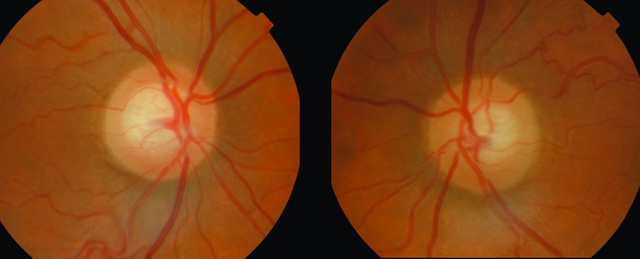
Fig. 14.7 Glaucome primitif à angle ouvert bilatéral : excavation glaucomateuse asymétrique. L’image présente une vue bilatérale du fond d’œil montrant deux papilles optiques atteintes de glaucome primitif à angle ouvert, avec une nette asymétrie des excavations. À gauche, l’excavation est très marquée, occupant une large portion du disque, traduisant une atteinte axonale sévère. À droite, l’excavation est plus modérée, avec un bord neuro-rétinien encore partiellement conservé. Les deux nerfs optiques présentent une décoloration centrale typique, sans œdème ni hémorragie. Les vaisseaux papillaires semblent refoulés et s’insèrent en périphérie. Ce contraste souligne l’évolution inégale de la neuropathie glaucomateuse entre les deux yeux.
- • anomalies de la structure visibles avec des examens complémentaires : l’OCT est une technique d’interférométrie possédant une résolution voisine de 5 microns. Elle peut ainsi calculer des surfaces et des volumes et fournir des variables quantitatives utiles pour évaluer une éventuelle dégradation de la maladie glaucomateuse par rapport à une base de données de référence (fig. 14.8). Elle est utile pour le diagnostic positif et le diagnostic différentiel du GPAO ainsi que pour l’évaluation du suivi et de l’efficacité des traitements mis en place;

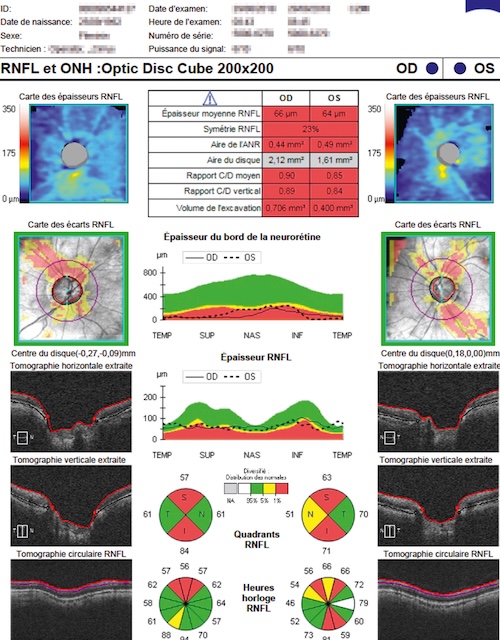
Fig. 14.8 Mesure de l’épaisseur des fibres optiques à la papille par tomographie en cohérence optique (OCT). Ce document présente une analyse détaillée de la tête du nerf optique et de la couche de fibres nerveuses rétiniennes (RNFL) par tomographie en cohérence optique. On observe une asymétrie significative entre les deux yeux, avec une réduction marquée de l’épaisseur moyenne de la RNFL à gauche (66 µm) comparée à droite (94 µm). Les cartes de déviation RNFL confirment une atteinte inférieure et supérieure gauche, suggérant un amincissement pathologique. Le rapport C/D vertical atteint 0,69 à gauche, traduisant une excavation papillaire élargie. L’analyse sectorielle montre plusieurs secteurs en rouge (valeurs pathologiques), surtout dans les quadrants inférieurs et supérieurs gauches.
- • anomalies de la fonction : pour le GPAO, l’acuité visuelle centrale est touchée très tardivement; c’est donc un examen très peu sensible. L’examen clé est le champ visuel réalisé aujourd’hui avec la périmétrie statique automatisée (PSA). Cet examen qui prend aujourd’hui environ 5 minutes par œil exige une bonne coopération et une bonne compréhension du test. Des stimuli lumineux statiques sont présentés sur une coupole avec une intensité déterminée correspondant à la sensibilité des points rétiniens explorés (environ une cinquantaine) et comparés à une base de données de référence (fig. 14.9 et fig. 14.10). Là encore, les données chiffrées permettent d’établir un diagnostic de neuropathie et d’évaluer le suivi et l’efficacité des traitements.


Fig. 14.9 Périmétrie statique automatisée d’un glaucome primitif à angle ouvert à l’œil droit; sco-tome inférieur arciforme. Sur cette périmétrie statique automatisée de l’œil droit, on observe une perte de sensibilité marquée en inférieur, dessinant un scotome arciforme bien individualisé, typique d’un glaucome primitif à angle ouvert. Les points de test dans la zone inférieure montrent une dépression significative, allant d’une réduction modérée à une abolition quasi complète des seuils. Le champ visuel supérieur reste largement préservé, ce qui accentue le contraste avec l’altération inférieure. Cette asymétrie est classique dans les atteintes précoces à modérées du nerf optique glaucomateux, notamment lorsque l’excavation papillaire est supérieure. L’analyse confirme une atteinte fonctionnelle déjà bien installée.

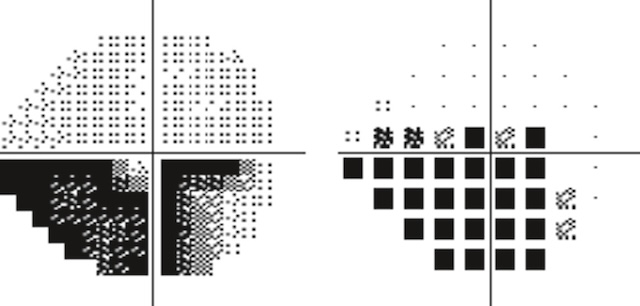
Fig. 14.10 Aggravation des déficits périmétriques 7 ans plus tard chez le même patient qu’à la figure 14.9. Cette périmétrie statique automatisée met en évidence une aggravation marquée des déficits du champ visuel inférieur. Le scotome arciforme s’est étendu et fusionne désormais avec la zone centrale, traduisant une atteinte fonctionnelle plus sévère. Les points noirs denses indiquent une perte quasi complète de sensibilité dans l’hémichamp inférieur. L’atteinte paracentrale est également visible, suggérant une altération du champ visuel impactant directement les activités visuelles fines. Cette évolution au fil des années reflète une progression typique du glaucome non stabilisé.
L’altération du champ visuel est principalement marquée par l’apparition de scotomes dont la topographie et la forme sont parfois évocatrices :
256En l’absence de traitement, le glaucome évolue vers une dégradation progressive et irréversible du champ visuel (champ visuel tubulaire), celui-ci étant réduit à un simple croissant temporal et à un îlot central de vision. À ce stade, l’acuité visuelle centrale diminue rapidement et la gêne fonctionnelle est majeure; la papille optique est très excavée.
F 257258259Principes thérapeutiques
![]() Le traitement du GPAO repose sur la correction du seul facteur de risque accessible à un traitement, la PIO. Abaisser la PIO a été reconnu comme bénéfique par de grandes études cliniques pour stopper l’évolution du GPAO, aussi bien pour le GPAO à PIO élevée que pour le GPAO à PIO normale.
Le traitement du GPAO repose sur la correction du seul facteur de risque accessible à un traitement, la PIO. Abaisser la PIO a été reconnu comme bénéfique par de grandes études cliniques pour stopper l’évolution du GPAO, aussi bien pour le GPAO à PIO élevée que pour le GPAO à PIO normale. ![]() Hormis les cas les plus avancés où la chirurgie s’impose dès le diagnostic fait, la thérapeutique est d’abord médicale.
Hormis les cas les plus avancés où la chirurgie s’impose dès le diagnostic fait, la thérapeutique est d’abord médicale.
1 Traitement médical
Le traitement médical est généralement prescrit « à vie » et ne doit pas être interrompu inopinément. Le choix se fait essentiellement en fonction des contre-indications et des effets indésirables de chacune des classes thérapeutiques, même si les collyres à base de prostaglandines et les collyres bêta-bloquants sont généralement prescrits en première intention (tableau 14.1).
![]() De nombreux médicaments sont disponibles, sous forme locale ou générale, agissant selon des mécanismes différents :
De nombreux médicaments sont disponibles, sous forme locale ou générale, agissant selon des mécanismes différents :
![]() Un collyre à base de prostaglandines est le plus souvent prescrit en première intention à raison d’une seule goutte le soir. La tolérance générale des analogues des prostaglandines est excellente; seule la tolérance locale de ces collyres peut poser problème, avec risque de rougeur ou d’irritation oculaire. Au bout de quelques mois de traitement, ils peuvent entraîner une modification de la coloration de l’iris (qui apparaît plus sombre) et accélérer la pousse des cils, effet secondaire dont le patient doit être prévenu.
Un collyre à base de prostaglandines est le plus souvent prescrit en première intention à raison d’une seule goutte le soir. La tolérance générale des analogues des prostaglandines est excellente; seule la tolérance locale de ces collyres peut poser problème, avec risque de rougeur ou d’irritation oculaire. Au bout de quelques mois de traitement, ils peuvent entraîner une modification de la coloration de l’iris (qui apparaît plus sombre) et accélérer la pousse des cils, effet secondaire dont le patient doit être prévenu.
260Un collyre bêta-bloquant peut également être prescrit en première intention sauf contre-indication; le plus connu est le timolol. Il est prescrit à raison d’une goutte matin et soir ou à libération prolongée, prescrite une fois par jour. Du fait de son passage systémique, sa prescription doit respecter les contre-indications des bêta-bloquants.
Les autres collyres hypotonisants sont prescrits soit en deuxième intention lorsque les bêta-bloquants et/ou les analogues des prostaglandines n’ont pas une efficacité suffisante, soit en première intention en cas de contre-indication aux bêta-bloquants ou d’intolérance aux prostaglandines.
On peut être amené à associer plusieurs collyres hypotonisants, sans dépasser en règle une « trithérapie » :
Certains collyres associent deux principes actifs pour faciliter le traitement et en améliorer l’observance par le patient.
Ce n’est que dans certains cas que l’on peut être amené à associer au traitement local de l’acé-tazolamide (Diamox®) par voie générale. Il est prescrit rarement au long cours. Le Diamox® comporte effectivement des effets secondaires fréquents et invalidants : acidose métabolique, hypokaliémie, lithiase rénale. Ses contre-indications sont l’insuffisance rénale, l’insuffisance hépatique sévère, l’allergie aux sulfamides, une lithiase rénale (avis urologique nécessaire).
2 261Trabéculoplastie au laser
![]() Entre médicaments et chirurgie, la trabéculoplastie au laser consiste à réaliser une photocoagulation sélective de l’angle iridocornéen, ce qui entraîne un meilleur écoulement de l’humeur aqueuse au niveau du trabéculum. Son effet s’estompe avec le temps, mais ce traitement peut être répété, et constitue une option thérapeutique valable dans des cas sélectionnés.
Entre médicaments et chirurgie, la trabéculoplastie au laser consiste à réaliser une photocoagulation sélective de l’angle iridocornéen, ce qui entraîne un meilleur écoulement de l’humeur aqueuse au niveau du trabéculum. Son effet s’estompe avec le temps, mais ce traitement peut être répété, et constitue une option thérapeutique valable dans des cas sélectionnés.
3 Traitement chirurgical
La chirurgie repose essentiellement sur la chirurgie filtrante (fig. 14.11) qui consiste en une fistulisation sous-conjonctivale de l’humeur aqueuse. La trabéculectomie est la procédure de référence. Après incision conjonctivale, on pratique un volet scléral lamellaire sous lequel est pratiquée une ablation sectorielle limitée du trabéculum; c’est une résection pleine épaisseur qui met en relation directe l’humeur aqueuse et l’espace sous-conjonctival.

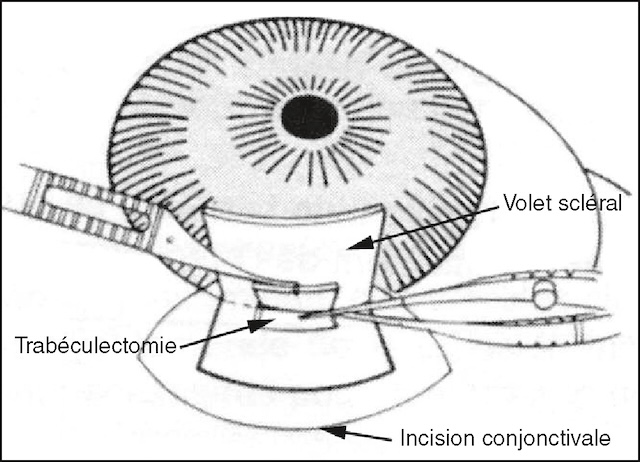
Ce schéma illustre un œil en cours d’intervention. La conjonctive a été incisée pour accéder au blanc de l’œil. Juste en dessous, un volet scléral est soulevé avec précision. Dans cet espace, une ouverture est pratiquée au niveau du trabéculum, pour permettre à l’humeur aqueuse de s’évacuer par une voie alternative. Ce drainage dérivé contourne la zone trabéculaire habituellement responsable du blocage dans le glaucome. Le liquide s’écoule alors lentement vers l’espace sous-conjonctival, où il sera ensuite réabsorbé. Cette manœuvre, bien calibrée, vise à baisser la pression oculaire tout en préservant la structure du globe.
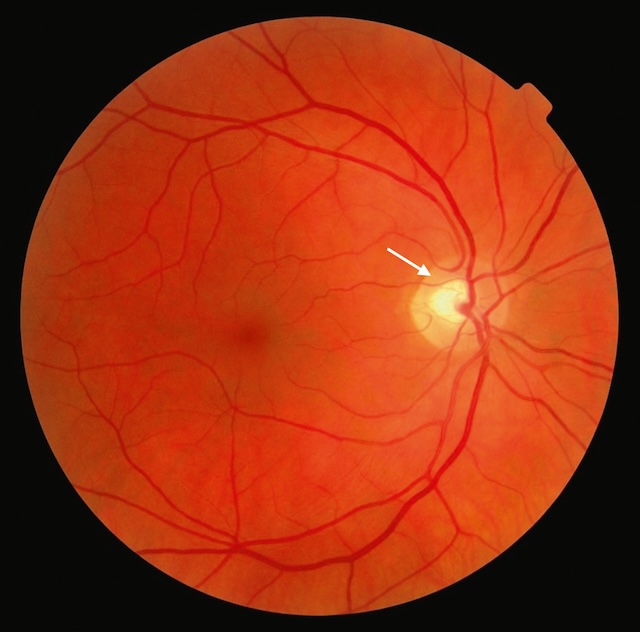
Sur cette image couleur du fond d’œil, on observe une rétine bien vascularisée, sans anomalies apparentes. Les artères et les veines rétiniennes se ramifient à partir de la papille optique, située légèrement à droite du centre. Cette papille est de forme ovale, bien délimitée, et présente un reflet central plus clair, signalé par une flèche discrète. Aucun signe d’œdème, d’excavation excessive ou d’hémorragie n’est visible. Le fond rétinien est d’aspect homogène, avec une macula discrète mais bien centrée, et aucun dépôt ou lésion pigmentaire anormale ne s’impose à l’analyse. L’ensemble suggère un aspect physiologique.
Une variante de cette chirurgie ne comportant que l’exérèse partielle du trabéculum (avec respect de la paroi sclérale sans ouverture du globe oculaire) est la sclérectomie profonde non perforante.
![]() Enfin, ces dernières années, ont été développées de nouvelles techniques dites « micro-invasives ». Elles sont en cours d’évaluation. Elles consistent à drainer l’humeur aqueuse à l’aide de petits drains ou petits tubes, permettant un meilleur contrôle du débit d’humeur aqueuse sortant de l’œil. Le principe est le même que la trabéculectomie, mais avec moins de complications et avec une récupération visuelle plus rapide.
Enfin, ces dernières années, ont été développées de nouvelles techniques dites « micro-invasives ». Elles sont en cours d’évaluation. Elles consistent à drainer l’humeur aqueuse à l’aide de petits drains ou petits tubes, permettant un meilleur contrôle du débit d’humeur aqueuse sortant de l’œil. Le principe est le même que la trabéculectomie, mais avec moins de complications et avec une récupération visuelle plus rapide.
Les complications des chirurgies filtrantes sont relativement rares mais doivent être recherchées : cataracte; hypotonie précoce compliquée de décollement choroïdien; infection du globe oculaire par la bulle de filtration.
La principale cause d’échec de la chirurgie filtrante est liée à la fermeture progressive et prématurée de la voie de drainage réalisée par fibrose sous-conjonctivale. Chez les patients à haut risque d’échec chirurgical (patients jeunes, mélanodermes), la cicatrisation peut être combattue par des antimétabolites appliqués au site opératoire (mitomycine C, 5-fluoro-uracile).
G Suivi
La surveillance doit porter sur l’évaluation régulière de la PIO, de l’aspect de la tête du nerf optique (fond d’œil et OCT) et du champ visuel, généralement tous les 6 mois. Le traitement est ajusté en cas d’aggravation trop rapide des altérations du champ visuel et/ou de l’excavation papillaire.
262Le traitement chirurgical est envisagé en cas d’échec du traitement médical, de glaucome évolué ou lorsque le patient est jeune. L’intolérance des collyres ou la coexistence d’une cataracte constituent également une indication chirurgicale dans des cas sélectionnés.
III Autres formes de glaucomes
A Glaucomes à angle ouvert secondaires
La neuropathie optique glaucomateuse est également présente, mais il existe des causes identifiables à l’élévation de la PIO. On peut citer ici : le glaucome exfoliatif; le glaucome pig-mentaire; les glaucomes post-traumatiques, infectieux ou inflammatoires (lors d’uvéites, par exemple), post-chirurgicaux et post-médicamenteux (après corticoïdes, par exemple). Le diagnostic, la surveillance et es modalités thérapeutiques sont identiques au GPAO.
B Glaucomes par fermeture de l’angle
L’élévation chronique de la PIO est secondaire à une fermeture de l’angle iridocornéen, du fait d’une apposition progressive de l’iris contre le trabéculum empêchant l’évacuation de l’humeur aqueuse en dehors de l’œil. Cette apposition est généralement secondaire à une gêne à l’écoulement de l’humeur aqueuse de la chambre postérieure (espace en arrière de l’iris) vers la chambre antérieure (espace en avant de l’iris), avec une pression plus élevée en chambre postérieure qu’en chambre antérieure. Le gradient de pression repousse la base de l’iris vers le trabéculum. La gêne à l’écoulement de l’humeur aqueuse par la pupille est appelée « blocage (ou bloc) pupillaire ».
Les glaucomes chroniques par fermeture de l’angle sont plus fréquents que les GPAO en Asie. La présentation clinique est très voisine de celle des GPAO, mais avec souvent une PIO plus élevée et une évolution plus rapide, et de ce fait un risque de perte de la fonction visuelle plus rapide. Le bilan est identique, avec comme seule différence la constatation d’un angle irido-cornéen étroit ou fermé en gonioscopie.
Le traitement consiste également à abaisser la PIO pour éviter la neuropathie glaucomateuse. En première intention, on réouvre l’angle iridocornéen en réalisant soit une petite perforation de l’iris au laser – appelée iridotomie laser –, soit une chirurgie de la cataracte si le sujet est âgé et présente des opacités cristalliniennes. Ces procédures facilitent l’écoulement de l’humeur aqueuse de la chambre postérieure vers la chambre antérieure, et éloignent l’iris du trabéculum. Si ce n’est pas suffisant, les autres étapes du traitement sont les mêmes que celles d’un GPAO.
IV Diagnostics différentiels
![]() L’hypertonie oculaire se définit comme une PIO supérieure à 21 mmHg, un angle confondue avec un glaucome, elle touche 10 fois plus d’individus. Elle nécessite une surveillance mais pas forcément un traitement. Elle constitue le facteur de risque le mieux identifié pour le GPAO.
L’hypertonie oculaire se définit comme une PIO supérieure à 21 mmHg, un angle confondue avec un glaucome, elle touche 10 fois plus d’individus. Elle nécessite une surveillance mais pas forcément un traitement. Elle constitue le facteur de risque le mieux identifié pour le GPAO.
B 263Neuropathies optiques non glaucomateuses
Les neuropathies optiques non glaucomateuses sont nombreuses : neurologiques, médicamenteuses, dégénératives, tumorales, traumatiques, vasculaires, etc. Le contexte clinique est souvent parlant et les atteintes du champ visuel souvent différentes du GPAO. Cependant, elles peuvent rester difficiles à distinguer d’un GPAO à PIO normale.
 Compléments en ligne
Compléments en ligne
Vous réalisez l’examen ophtalmologique d’un patient de 52 ans et mesurez la pression intraoculaire (PIO). Celle-ci est de 18 mmHg à droite et 19 mmHg à gauche. Quelles sont les valeurs normales de la PIO ?
Un patient de 27 ans qui prend en automédication des corticoïdes en collyres pour une conjonctivite allergique présente une hypertonie oculaire bilatérale importante, la pression intraoculaire (PIO) étant mesurée à 35 mmHg aux deux yeux. Quels traitements parmi les suivants peuvent être donnés pour réduire la PIO ?
L’examen du fond d’œil d’un patient de 65 ans sans antécédents ophtalmologiques est présenté ci-dessous.
Quel est l’élément anatomique désigné par une flèche blanche ?
Une patiente de 72 ans présente un glaucome primitif à angle ouvert bilatéral traité par un collyre à base d’analogues de prostaglandines et de bêta-bloquants (combinaison fixe). Quels examens parmi les suivants ont pu être utilisés pour le diagnostic de son glaucome ?
Parmi les traitements suivants, lequel (lesquels) peut (peuvent) être utilisé(s) en cas de crise de fermeture de l’angle ?
 265Réponses
265Réponses
Les corticoïdes ont pour effet indésirable possible d’augmenter la PIO.
Réponse : papille optique, ou tête du nerf optique. Il existe ici une déformation irrégulière du bord de creux papillaire (cup) pouvant faire suspecter une atteinte glaucomateuse des fibres neurorétiniennes.
La kératométrie, c’est-à-dire les valeurs de courbures cornéennes, n’est pas utile, à la différence de l’épaisseur cornéenne, la pachymétrie, qui permet d’interpréter plus finement la valeur de PIO mesurée par aplanation cornéenne.
A : resserre la pupille et libère l’angle iridocornéen. B et D : abaissent la PIO. C et E : ce sont des mydriatiques contre-indiqués avant iridotomie périphérique.
 Compléments en ligne
Compléments en ligne
Des compléments numériques sont associés à ce chapitre. Ils sont indiqués dans le connectez-vous sur http://www.em-consulte.com/e-complements/478662 et suivez les instructions.
Vidéo 14.1. Mesure de la pression intraoculaire par aplanation.
