CHAPITRE 15: Items 81 et 82 Dégénérescence maculaire liée à l'âge
Pr C. Dot, CHU Edouard Herriot, Lyon
Situations cliniques de départ
La DMLA peut être évoquée dans les situations cliniques suivantes.
 27 – Chute de la personne âgée : la vision apportant environ 80 % des informations sensorielles, une baisse de l’acuité visuelle ou une malvoyance peuvent être la cause de chute chez les personnes âgées atteintes de DMLA. Cela est d’autant plus impactant que la DMLA se bilatéralise dans 50 % des cas à 5 ans.
27 – Chute de la personne âgée : la vision apportant environ 80 % des informations sensorielles, une baisse de l’acuité visuelle ou une malvoyance peuvent être la cause de chute chez les personnes âgées atteintes de DMLA. Cela est d’autant plus impactant que la DMLA se bilatéralise dans 50 % des cas à 5 ans.
 138 – Anomalie de la vision : la DMLA se manifeste par des métamorphopsies, une sensation de scotome et une baisse de l’acuité visuelle.
138 – Anomalie de la vision : la DMLA se manifeste par des métamorphopsies, une sensation de scotome et une baisse de l’acuité visuelle.
 247 – Prescription d’une rééducation : en cas de baisse de l’acuité visuelle bilatérale, la rééducation basse vision pourra être prescrite afin d’améliorer les gestes quotidiens.
247 – Prescription d’une rééducation : en cas de baisse de l’acuité visuelle bilatérale, la rééducation basse vision pourra être prescrite afin d’améliorer les gestes quotidiens.
 328 – Annonce d’une maladie chronique : la DMLA est une pathologie chronique. Dans sa forme exsudative, elle va requérir des injections intravitréennes à répétition sur plusieurs années ainsi que des contrôles réguliers. Les schémas thérapeutiques seront expliqués au patient pour obtenir son adhésion.
328 – Annonce d’une maladie chronique : la DMLA est une pathologie chronique. Dans sa forme exsudative, elle va requérir des injections intravitréennes à répétition sur plusieurs années ainsi que des contrôles réguliers. Les schémas thérapeutiques seront expliqués au patient pour obtenir son adhésion.
 345 – Situation de handicap : celui de la malvoyance, l’adaptation du poste de travail, les associations.
345 – Situation de handicap : celui de la malvoyance, l’adaptation du poste de travail, les associations.
 352 – Expliquer un traitement au patient : expliquer les raisons des injections intravitréennes d’anti-VEGF dans la forme exsudative, quels produits et les stratégies de traitement. Dans la forme atrophique, expliquer aussi qu’actuellement la prise en charge est limitée, mais que de nombreux axes de recherche sont en cours d’évaluation.
352 – Expliquer un traitement au patient : expliquer les raisons des injections intravitréennes d’anti-VEGF dans la forme exsudative, quels produits et les stratégies de traitement. Dans la forme atrophique, expliquer aussi qu’actuellement la prise en charge est limitée, mais que de nombreux axes de recherche sont en cours d’évaluation.
Hiérarchisation des connaissances
| Rang | Rubrique | Intitulé | Descriptif |
| Item 81 | |||
|
|
Prévalence, épidémiologie | Connaître l’épidémiologie de la cataracte* | |
|
|
Prévalence, épidémiologie | Connaître l’épidémiologie de la DMLA | |
|
|
Définition | Connaître la définition de la DMLA | |
|
|
Définition | Connaître la définition de la cataracte, ses principales causes, et les modalités de diagnostic clinique* | |
|
|
Diagnostic positif | Connaître la séméiologie et les moyens de dépistage d’un syndrome maculaire | |
|
|
Diagnostic positif | Connaître les pathologies maculaires chroniques hors DMLA (membrane épirétinienne, trou maculaire, œdème maculaire)* | |
|
|
Étiologies | Connaître les principales étiologies d’altération chronique de la vision* | Interrogatoire et examen clinique |
|
|
Étiologies | Connaître les grandes familles médicamenteuses à l’origine d’une altération chronique de la vision* | Atteinte de la rétine, du cristallin ou du nerf optique |
|
|
Examens complémentaires | Connaître les principaux examens complémentaires en ophtalmologie et leurs indications | Atteinte du segment antérieur, du nerf optique (objectif commun avec item 80), de la rétine (AV, angiographie, OCT maculaire, ERG) |
|
|
Contenu multimédia | Savoir interpréter un réflexe photomoteur direct et consensuel (objectif commun avec item 82)* | |
| Item 82 | |||
|
|
Identifier une urgence | Conduite à tenir devant une baisse de vision brutale avec œil blanc et identification des urgences | |
|
|
Identifier une urgence | Savoir évoquer un décollement de rétine* | Description sémiologique |
|
|
Définition | Connaître la définition, la signification, et la démarche étiologique devant une cécité monoculaire transitoire* | |
|
|
Diagnostic positif | Savoir déterminer si un trouble visuel est mono- ou binoculaire | |
|
|
Diagnostic positif | Savoir interpréter un réflexe photomoteur direct et consensuel (objectif commun avec item 81)* | |
|
|
Diagnostic positif | Savoir évoquer le diagnostic d’aura migraineuse* | AIT, crise épileptique partielle |
|
|
Diagnostic positif | Connaître les signes cliniques des affections vasculaires de la rétine (OACR, OVCR), leurs complications (néovascularisation, glaucome néovasculaire, œdème maculaire) et les principes de traitement* | |
|
|
Diagnostic positif | Connaître les signes cliniques d’une neuropathie optique (NOIA, NORB, œdème papillaire)* | |
|
|
Diagnostic positif | Connaître les diagnostics différentiels de l’aura migraineuse* | Décollement de rétine, glaucome, hémorragie du vitré |
|
|
Diagnostic positif | Connaître la présentation clinique, les modes de survenue, les facteurs de risque des décollements de rétine* | |
|
|
Diagnostic positif | Connaître les signes cliniques d’une hémorragie du vitré et ses principales causes* | Acuité visuelle, champ visuel, PEV, OCT |
|
|
Étiologies | Connaître les principales causes d’atteinte des voies optiques et du nerf optique et identifier les étiologies nécessitant une prise en charge urgente (NOIAA, œdème papillaire)* | |
|
|
Examens complémentaires | Connaître les principaux examens complémentaires en ophtalmologie et leurs indications | Atteinte du segment antérieur, du nerf optique (objectif commun avec item 81), de la rétine (AV, angiographie, OCT maculaire, ERG) |
|
|
Examens complémentaires | Indications de l’imagerie devant un trouble visuel récent* | |
|
|
Contenu multimédia | Interpréter un réflexe photomoteur direct et consensuel (objectif commun avec item 81)* | |
|
|
Contenu multimédia | Photographie d’un œdème papillaire* | |
|
|
Contenu multimédia | Photographie d’un champ visuel des deux yeux avec hémianopsie (quadranopsie) latérale homonyme (ou bitemporale)* | Y compris déficit pupillaire afférent relatif |
| Item 122 | |||
|
|
Définition | Connaître le rôle du médecin; connaître le rôle des auxiliaires médicaux | Orthoptie basse vision |
|
|
Prise en charge | Connaître de la principales indications d’un programme de rééducation; connaître les principaux objectifs de la rééducation | Rééducation basse vision |
|
|
Prise en charge | Connaître les règles d’arrêt de la rééducation |

I Introduction
![]() La dégénérescence maculaire liée à l’âge (DMLA) est une atteinte dégénérative de la macula, survenant chez des sujets de plus de 50 ans.
La dégénérescence maculaire liée à l’âge (DMLA) est une atteinte dégénérative de la macula, survenant chez des sujets de plus de 50 ans.
L’atteinte est uni- ou bilatérale, mais peut être asymétrique. Deux stades d’évolution sont identifiés : le premier est celui de la maculopathie liée à l’âge (MLA) incluant les stades débutants sans ou avec peu de retentissement fonctionnel. Le second est le stade évolué : celui de la dégénérescence maculaire liée à l’âge (DMLA), comprenant deux formes, DMLA atrophique et DMLA néovasculaire. Ce dernier stade est caractérisé sur le plan fonctionnel par une baisse de l’acuité visuelle, un scotome central et/ou des métamorphopsies (en cas de DMLA exsudative).
270271La MLA est caractérisée cliniquement au fond d’œil par la présence :
La MLA est compatible avec une acuité visuelle normale ou peu abaissée, d’où l’intérêt des campagnes de dépistage.
La DMLA comprend, quant à elle, deux formes qui peuvent coexister :
Ces formes évoluées entraînent une baisse d’acuité visuelle lentement progressive pour la forme atrophique, alors que le mode d’entrée est brutal pour la forme exsudative (puis devient chronique dans la foulée).
La sémantique DMLA néovasculaire et DMLA atrophique sera employée dans le texte.
II Prévalence
![]() La DMLA est la première cause de malvoyance après 50 ans dans les pays industrialisés. La prévalence globale de la maladie est de 18 % après 50 ans, se décomposant en 17,5 % pour les formes débutantes MLA et 0,5 % pour les formes évoluées DMLA. Parmi les DMLA, les formes atrophiques sont plus fréquentes que les formes néovasculaires. Une récente étude française (Landscape big data, 2023) rapportait une prévalence de la DMLA néovasculaire traitée à 1 % de la population française de plus de 50 ans.
La DMLA est la première cause de malvoyance après 50 ans dans les pays industrialisés. La prévalence globale de la maladie est de 18 % après 50 ans, se décomposant en 17,5 % pour les formes débutantes MLA et 0,5 % pour les formes évoluées DMLA. Parmi les DMLA, les formes atrophiques sont plus fréquentes que les formes néovasculaires. Une récente étude française (Landscape big data, 2023) rapportait une prévalence de la DMLA néovasculaire traitée à 1 % de la population française de plus de 50 ans. ![]() La prévalence augmente avec l’âge.
La prévalence augmente avec l’âge. ![]() Une étude européenne (méta-analyse de 2017), incluant formes atrophiques et exsuda-tives, rapportait une prévalence de :
Une étude européenne (méta-analyse de 2017), incluant formes atrophiques et exsuda-tives, rapportait une prévalence de :
Enfin, le risque de bilatéralisation à 5 ans est estimé à 50 % pour la DMLA exsudative. Cela justifie la surveillance régulière de l’œil controlatéral lorsqu’un premier œil est déjà traité.
III Facteurs de risque
Les principaux facteurs de risque des stades évolués de DMLA sont l’âge, l’origine ethnique, la génétique et des facteurs environnementaux (nutrition et tabagisme) :
- • âge (voir ci-dessus « Prévalence »);
- • origine ethnique : les populations européennes sont le plus à risque de développer une DMLA versus les populations africaines, tandis que les populations asiatiques ont des formes particulières polypoïdales;
- • génétique : des études épidémiologiques et de génétique moléculaire ont montré une forte association entre la DMLA et le polymorphisme du facteur H du complément, dont le gène est situé sur le chromosome 1;
- • tabagisme : il augmente le risque de DMLA par trois et même par cinq chez le très grand fumeur. Ce risque persiste plusieurs années après l’arrêt du tabagisme;
- • régime alimentaire : un régime pauvre en antioxydants ou riche en acides gras saturés et cholestérol augmente le risque de DMLA. En ce sens, le régime « méditerranéen » riche en légumes verts, en poisson et utilisant l’huile d’olive est conseillé en prévention.
IV 272Diagnostic
![]() Les circonstances sont les suivantes :
Les circonstances sont les suivantes :
- • baisse progressive de l’acuité visuelle de loin et de près, correspondant à l’aggravation lente des lésions (forme atrophique);
- • baisse brutale de l’acuité visuelle associée à des métamorphopsies (sensation de déformation des objets, ondulation des lignes droites) signant le syndrome maculaire. Les métamorphopsies sont liées, dans le cas de la DMLA, à l’apparition de néovaisseaux choroïdiens (sous l’EP), responsables d’une exsudation et de l’accumulation de liquide au niveau de la macula;
- • scotome central profond, correspondant aux stades très avancés de la maladie.
B Examen clinique
- • la mesure de l’acuité visuelle, de loin et de près;
- • la recherche d’un scotome central ou de métamorphopsies qui peuvent être objectivés en présentant au patient une grille d’Amsler, constituée d’un quadrillage régulier (fig. 15.2);

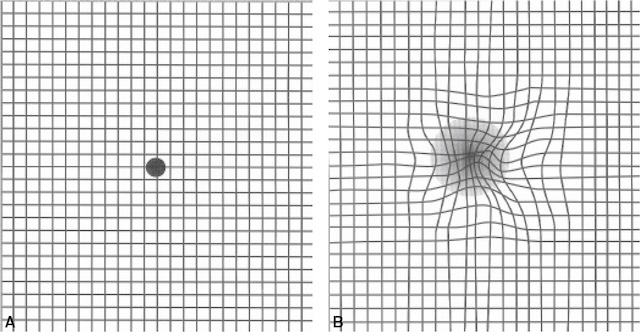
Fig. 15.2 Grille d’Amsler.
A. Sujet normal. B. Métamorphopsies et scotome central relatif.À gauche, la grille d’Amsler apparaît parfaitement régulière, avec un point de fixation central bien net, témoignant d’une perception visuelle centrale normale. En revanche, à droite, la déformation marquée des lignes, qui semblent se tordre vers le centre, illustre une métamorphopsie nette. On observe également un assombrissement diffus central, ce qui peut correspondre à une baisse de la sensibilité maculaire. Ce type d’altération du champ visuel central est évocateur d’une atteinte maculaire, notamment de type DMLA. La confrontation entre les deux grilles souligne l’importance du dépistage par cet outil simple mais révélateur.
- • un examen du fond d’œil : l’examen biomicroscopique du fond d’œil
 pratiqué à la lampe à fente, après dilatation pupillaire, ou
pratiqué à la lampe à fente, après dilatation pupillaire, ou  la photographie en couleurs du fond d’œil, recherchant (voir plus loin « Formes cliniques ») :
la photographie en couleurs du fond d’œil, recherchant (voir plus loin « Formes cliniques ») :
C 273Tomographie en cohérence optique (OCT)
L’examen OCT est incontournable dans le diagnostic de la DMLA. Il permet de visualiser, sur des images en coupe de la macula (B-scan), soit l’atrophie de l’EP dans les formes atrophiques, soit les signes d’une néovascularisation choroïdienne dans la forme exsudative. Les signes OCT, dans ce dernier cas, sont un œdème maculaire (augmentation de l’épaisseur maculaire), la présence de matériel hyperréflectif (néovaisseaux) en avant ou en arrière de l’EP, la présence de liquide intrarétinien et/ou sous-rétinien (encore appelés fluides). Enfin, un décollement de l’EP sera souvent observé.
![]() Outre le diagnostic, l’OCT participe à la classification des néovaisseaux : type 1 pour les néovaisseaux en dessous de l’EP, type 2 pour les néovaisseaux au-dessus de l’EP et type 3 pour l’anastomose choriorétinienne. L’OCT est aussi incontournable pour le suivi de leur évolution sous traitement.
Outre le diagnostic, l’OCT participe à la classification des néovaisseaux : type 1 pour les néovaisseaux en dessous de l’EP, type 2 pour les néovaisseaux au-dessus de l’EP et type 3 pour l’anastomose choriorétinienne. L’OCT est aussi incontournable pour le suivi de leur évolution sous traitement.
D Angiographie du fond d’œil
![]() C’est la prise de clichés du fond d’œil après injection intraveineuse d’un colorant fluorescent, le plus souvent la fluorescéine. L’angiographie au vert d’indocyanine (ICG), autre colorant, permettant de mieux visualiser la circulation choroïdienne, peut être utilisée en complément dans certains cas. Les différents types de néovaisseaux ont en commun une hyperfluorescence maculaire croissante à la phase tardive de l’angiographie (fig. 15.3A,B).
C’est la prise de clichés du fond d’œil après injection intraveineuse d’un colorant fluorescent, le plus souvent la fluorescéine. L’angiographie au vert d’indocyanine (ICG), autre colorant, permettant de mieux visualiser la circulation choroïdienne, peut être utilisée en complément dans certains cas. Les différents types de néovaisseaux ont en commun une hyperfluorescence maculaire croissante à la phase tardive de l’angiographie (fig. 15.3A,B).

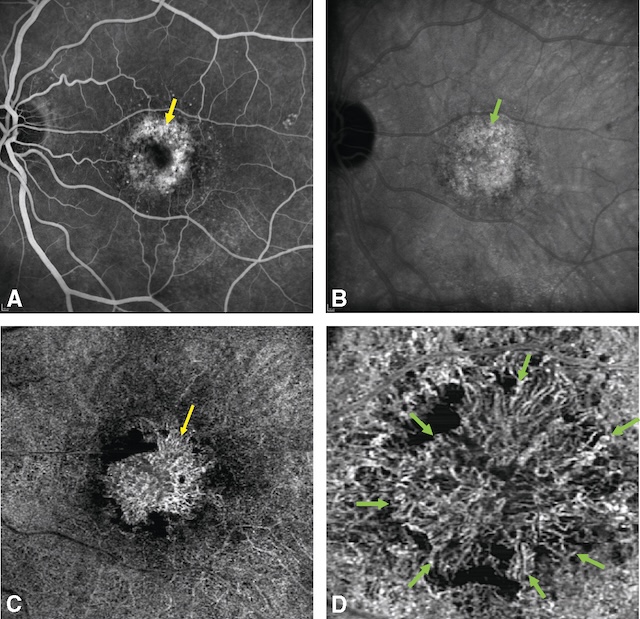
A. Angiographie à la fluorescéine montrant une hyperfluorescence maculaire hétérogène signant une néovascularisation choroïdienne (flèche jaune). B. Angiographie au vert d’indocyanine, hypercyanescence en plaque au temps tardif du néovaisseau (flèche verte). C. OCT-angiographie en fenêtre de 6 × 6 mm mettant en évidence sans injection de produit de contraste les détails de la plaque néovasculaire en raison de l’absence de diffusion avec cette technique (flèche jaune). D. OCT-angiographie en fenêtre de 3 × 3 mm montrant plus précisément l’arborescence néovasculaire détourée par les flèches vertes.
Les quatre clichés montrent différentes modalités d’exploration d’une membrane néovasculaire choroïdienne. Sur l’image A, la flèche jaune indique une hyperfluorescence centrale en guirlande, caractéristique d’une néovascularisation visible à la fluorescéine. L’image B, en autofluorescence, met en évidence une zone irrégulièrement hyperautofluorescente (flèche verte), traduisant une perturbation de l’épithélium pigmentaire. Sur l’image C, la flèche jaune désigne la néovascularisation choroïdienne en angiographie OCT, montrant un réseau dense et irrégulier. Enfin, l’image D, en angio-OCT en haute résolution, révèle une néovascularisation en aspect d’arborisation, soulignée par plusieurs flèches vertes.
E 274OCT-angiographie (OCT-A)
Cette technique plus récente (2015), fondée sur l’OCT, permet de visualiser la vascularisa-tion rétinienne et choroïdienne sans injection de colorant. Elle présente donc l’avantage de s’affranchir des allergies liées à la fluorescéine. ![]() Elle est maintenant largement répandue et utilisée pour le diagnostic de la DMLA ainsi que pour le suivi des patients (fig. 15.2C,D).
Elle est maintenant largement répandue et utilisée pour le diagnostic de la DMLA ainsi que pour le suivi des patients (fig. 15.2C,D).
V Formes cliniques
A Forme débutante, les précurseurs/drusen
![]() Le premier signe clinique est l’apparition de précurseurs, les drusen. Ceux-ci sont dus à l’accumulation de résidus de la phagocytose des photorécepteurs par les cellules de l’EP associé à des dépôts lipidiques situés sous l’EP de la rétine.
Le premier signe clinique est l’apparition de précurseurs, les drusen. Ceux-ci sont dus à l’accumulation de résidus de la phagocytose des photorécepteurs par les cellules de l’EP associé à des dépôts lipidiques situés sous l’EP de la rétine. ![]() Ces résidus s’accumulent anormalement entre l’EP et sa membrane basale (membrane de Bruch). Au fond d’œil, ils apparaissent comme de petites lésions profondes, blanchâtres ou jaunâtres, de forme et de taille variables. Ils sont particulièrement bien vus sur les coupes OCT où ils forment de petits soulèvements de l’EP (fig. 15.4).
Ces résidus s’accumulent anormalement entre l’EP et sa membrane basale (membrane de Bruch). Au fond d’œil, ils apparaissent comme de petites lésions profondes, blanchâtres ou jaunâtres, de forme et de taille variables. Ils sont particulièrement bien vus sur les coupes OCT où ils forment de petits soulèvements de l’EP (fig. 15.4).

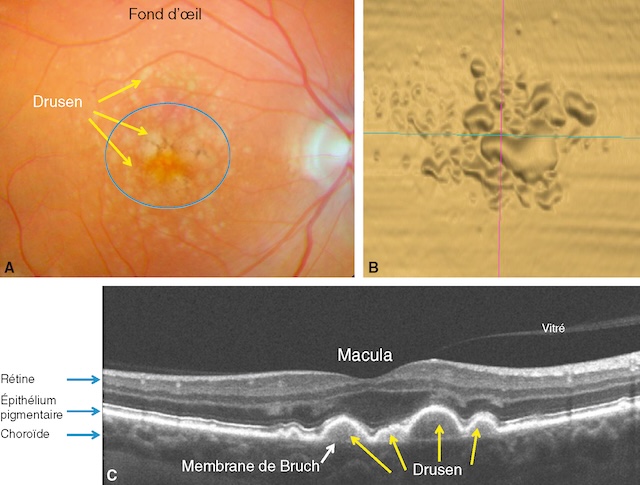
A. Photographie en couleurs du fond d’œil montrant de gros drusen en partie confluents, formant des taches jaunes (flèches) sous la rétine dans la région maculaire (l’ovale indique la macula). B. Tomographie en cohérence optique (OCT) « en face » : cartographie en face montrant le soulèvement occasionné par les dépôts lipo-protéiques des drusen. C. OCT, coupe passant par le centre de la macula. Les drusen, ici en section (flèches), soulèvent l’épithélium pigmentaire.
Les trois images illustrent différents aspects des drusen dans une maculopathie liée à l’âge. En A, le fond d’œil met en évidence plusieurs dépôts jaunâtres sous-rétiniens dans la zone maculaire, cerclée en bleu, correspondant à des drusen. L’image B offre un agrandissement en optique cohérente, montrant leur relief irrégulier. En C, l’image en coupe OCT montre clairement l’épaississement et la déformation de la membrane de Bruch par les drusen, visibles comme des soulèvements sous l’épithélium pigmentaire. La rétine sus-jacente semble globalement respectée, mais ces anomalies traduisent un stade précoce de dégénérescence maculaire.
B 275Forme atrophique
![]() La forme atrophique est caractérisée histologiquement par la disparition progressive des cellules de l’EP.
La forme atrophique est caractérisée histologiquement par la disparition progressive des cellules de l’EP. ![]() Cette perte s’accompagne aussi d’une disparition progressive des photorécepteurs sus-jacents et de la choriocapillaire sous-jacente.
Cette perte s’accompagne aussi d’une disparition progressive des photorécepteurs sus-jacents et de la choriocapillaire sous-jacente. ![]() Elle se traduit à l’examen du fond d’œil par des plages d’atrophie de l’EP (plaques claires) et de la choroïde qui commencent autour de la fovéa.
Elle se traduit à l’examen du fond d’œil par des plages d’atrophie de l’EP (plaques claires) et de la choroïde qui commencent autour de la fovéa. ![]() Elle évolue inexorablement, mais de façon très progressive, vers une extension des lésions qui vont englober la fovéa et entraîner une baisse d’acuité visuelle sévère avec scotome central irréversible (fig. 15.5).
Elle évolue inexorablement, mais de façon très progressive, vers une extension des lésions qui vont englober la fovéa et entraîner une baisse d’acuité visuelle sévère avec scotome central irréversible (fig. 15.5).

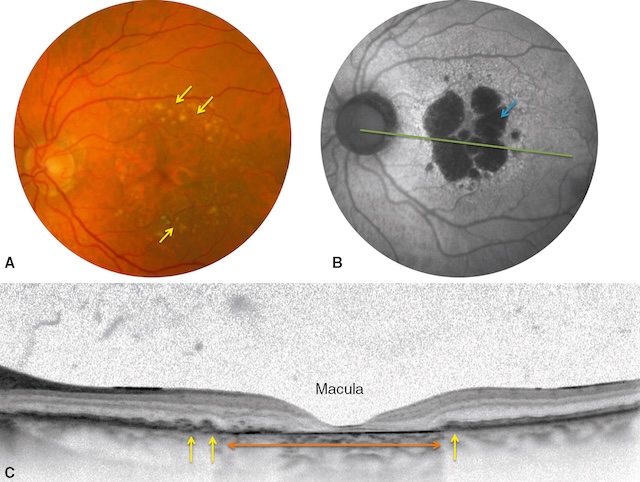
A. Photographie en couleurs du fond d’œil montrant de gros drusen (flèches) autour d’une zone centrale d’atrophie de l’épithélium pigmentaire (plages plus claires). B. Photographie en autofluorescence du fond d’œil. L’épithélium pigmentaire et les photorécepteurs ont la propriété d’être autofluorescents lorsque le fond d’œil est éclairé en lumière bleue. Les taches sombres centrales (flèche) représentent la zone d’atrophie de l’épithélium pigmentaire et de la rétine. C. Tomographie en cohérence optique, coupe passant par le centre de la macula (ligne verte fig. B). Cette coupe en section B-scan montre une atrophie des couches de la rétine externe et de l’épithélium pigmentaire en regard de la flèche orange (comparer avec la figure 15.4), soit toute la zone correspondant aux taches sombres en autofluorescence. Quelques drusen persistent en dehors de la zone atrophique (flèches jaunes).
L’image A montre un fond d’œil avec plusieurs plages dépigmentées bien visibles, correspondant à des zones d’atrophie géographique, typiques d’une forme avancée de DMLA atrophique. L’image B, en autofluorescence, met en évidence ces mêmes lésions sous forme de zones noires, traduisant une perte complète de l’épithélium pigmentaire. Enfin, l’image C en coupe OCT montre un amincissement marqué des couches rétiniennes au centre, avec une atrophie nette de la couche RPE-choroïde, confirmant l’atteinte centrale de la macula. L’ensemble évoque une évolution avancée avec atteinte sévère de la fonction visuelle centrale.
C 276Forme exsudative ou néovasculaire
![]() La forme exsudative est liée à l’apparition de néovaisseaux sous l’EP. Il s’agit de néovaisseaux issus de la choroïde (on parle de néovaisseaux choroïdiens) qui se développent initialement sous l’EP et qui franchissent pour certains (type 2) l’EP pour se développer directement sous la rétine maculaire. Cette néovascularisation choroïdienne entraîne un œdème intrarétinien, des hémorragies, surtout l’apparition de fluide dans la rétine (normalement sèche) et souvent un décollement de l’EP, responsable de la baisse d’acuité visuelle et des métamorphopsies d’apparition brutale (fig. 15.6).
La forme exsudative est liée à l’apparition de néovaisseaux sous l’EP. Il s’agit de néovaisseaux issus de la choroïde (on parle de néovaisseaux choroïdiens) qui se développent initialement sous l’EP et qui franchissent pour certains (type 2) l’EP pour se développer directement sous la rétine maculaire. Cette néovascularisation choroïdienne entraîne un œdème intrarétinien, des hémorragies, surtout l’apparition de fluide dans la rétine (normalement sèche) et souvent un décollement de l’EP, responsable de la baisse d’acuité visuelle et des métamorphopsies d’apparition brutale (fig. 15.6).

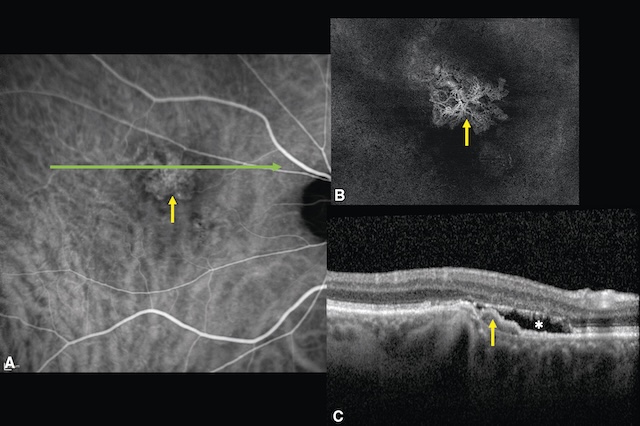
A. Angiographie à la fluorescéine montrant l’hyperfluorescence produite par la diffusion de colorant à partir des néovaisseaux choroïdiens (flèche jaune). B. OCT-angiographie montrant l’arborescence du néovaisseau (flèche), sans injection de colorant. C. OCT, coupe passant par la lésion (ligne verte, fig. A). La rétine est soulevée par les néovaisseaux choroïdiens (flèche jaune) situés sous l’épithélium pigmentaire, et présente du liquide sous-rétinien (astérisque) signant l’exsudation, donc l’activité du néovaisseau.
Sur l’image A, en angiographie à la fluorescéine, on distingue une néovascularisation choroïdienne avec un réseau vasculaire dense, irrégulier, situé au centre de la macula, typique d’une DMLA exsudative. L’image B, en angiographie OCT, confirme cette néovascularisation avec un aspect arborisé hyperréfléchissant. L’image C en coupe OCT montre un soulèvement de l’épithélium pigmentaire avec une hyperréflectivité linéaire en regard, traduisant l’infiltration néovasculaire. La présence de liquide sous-rétinien et de décollement de l’épithélium souligne l’activité de la lésion, confirmant une forme active nécessitant un traitement.
La forme exsudative de la DMLA provoque des complications fonctionnelles sévères rapidement évolutives; ![]() en l’absence de traitement, l’évolution tend vers une destruction des photorécepteurs, responsable d’une baisse d’acuité visuelle sévère et d’un scotome central définitifs.
en l’absence de traitement, l’évolution tend vers une destruction des photorécepteurs, responsable d’une baisse d’acuité visuelle sévère et d’un scotome central définitifs.
![]() Le constat d’une baisse d’acuité visuelle chez un patient connu pour avoir une MLA, des drusen justifie ainsi un examen ophtalmologique en urgence (dans les 48 heures) afin de détecter d’éventuels néovaisseaux choroïdiens et de les traiter immédiatement. Une hémorragie maculaire, encore appelée hématome maculaire, peut être inaugurale, à l’origine du diagnostic de la maladie DMLA en urgence (car baisse d’acuité visuelle brutale), ou émailler l’évolution de la DMLA (fréquence 4 % à 10 ans d’évolution) (fig. 15.7).
Le constat d’une baisse d’acuité visuelle chez un patient connu pour avoir une MLA, des drusen justifie ainsi un examen ophtalmologique en urgence (dans les 48 heures) afin de détecter d’éventuels néovaisseaux choroïdiens et de les traiter immédiatement. Une hémorragie maculaire, encore appelée hématome maculaire, peut être inaugurale, à l’origine du diagnostic de la maladie DMLA en urgence (car baisse d’acuité visuelle brutale), ou émailler l’évolution de la DMLA (fréquence 4 % à 10 ans d’évolution) (fig. 15.7). ![]() Cette complication est grave car très peu de patient retrouveront leur AV avant hématome.
Cette complication est grave car très peu de patient retrouveront leur AV avant hématome.

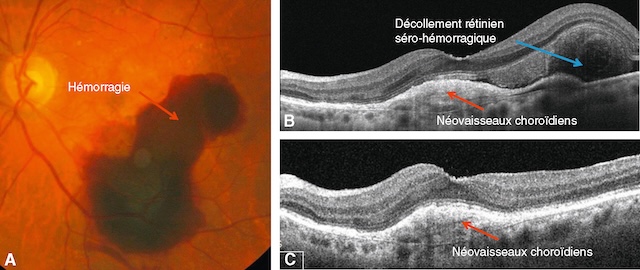
A. Photographie en couleurs du fond d’œil montrant une importante hémorragie maculaire. B. OCT, coupe horizontale passant par le centre de la macula, montrant les néovaisseaux choroïdiens et le décollement rétinien séro-hémorragique. C. Après trois injections d’anti-VEGF à 1 mois d’intervalle, la rétine s’est réappliquée. Les néovaisseaux choroïdiens sont cependant toujours présents sous la macula. Un traitement prolongé sera nécessaire.
L’image A montre un fond d’œil présentant une hémorragie maculaire étendue, sombre et irrégulière, occupant une grande partie de la région centrale, signe évocateur d’une DMLA exsudative compliquée. Sur l’image B, la coupe OCT révèle un soulèvement de la rétine lié à un décollement séro-hémorragique, associé à la présence de néovaisseaux choroïdiens hyperréflectifs sous-rétiniens. L’image C confirme également une prolifération néovasculaire choroïdienne, bien ancrée sous l’épithélium pigmentaire, avec un épaississement localisé. L’ensemble de ces signes est typique d’une forme néovasculaire active de DMLA avec composante hémorragique marquée.
VI 277Traitement
Au stade des drusen, une étude randomisée menée sur un grand nombre de patients, l’étude AREDS-2 (Age-Related Eye Disease Study, 2013) a montré l’intérêt d’une supplémentation per os quotidienne en vitamine E, vitamine C, zinc, lutéine et zéaxantine dans des doses bien définies. En effet, cette supplémentation retarde l’évolution des formes précoces vers les formes évoluées. En revanche, l’addition d’oméga-3 et de bêta-carotène, testée, ne réduit pas le risque de progression. Il est par ailleurs conseillé aux patients un régime alimentaire type méditerranéen riche en légumes verts (tels que le brocoli), en poissons et de préférer l’huile d’olive.
B Forme atrophique
![]() De nouveaux traitements anti-complément C3 et C5 administrés par injections intra-vitréennes ont obtenu l’agrément de la Food and Drug Administration (FDA) en 2023; ils sont en cours de procédure d’agrément pour l’Europe (European Medicines Agency [EMA]). Ils ont montré le ralentissement de la progression de l’atrophie à 2 et 3 ans, sans améliorer l’acuité visuelle. Leurs indications ciblées doivent être précisées.
De nouveaux traitements anti-complément C3 et C5 administrés par injections intra-vitréennes ont obtenu l’agrément de la Food and Drug Administration (FDA) en 2023; ils sont en cours de procédure d’agrément pour l’Europe (European Medicines Agency [EMA]). Ils ont montré le ralentissement de la progression de l’atrophie à 2 et 3 ans, sans améliorer l’acuité visuelle. Leurs indications ciblées doivent être précisées.
C Forme exsudative (néovasculaire)
Le traitement des néovaisseaux choroïdiens a été transformé par l’apparition des traitements anti-angiogéniques dirigés contre le vascular endothelial growth factor (VEGF) en 2007, le VEGF étant le principal stimulus à la néovascularisation choroïdienne. Les anti-VEGF sont administrés par injections intraoculaires (intravitréennes) répétées. L’injection est réalisée en consultation externe, dans des conditions d’asepsie oculaire, sous anesthésie topique (vidéo 15.1).
278Quatre médicaments ayant leur autorisation de mise sur le marché (AMM) sont utilisés pour la DMLA exsudative : le ranibizumab, l’aflibercept, le brolucizumab et le faricimab (par ordre d’arrivée sur le marché). Le rythme des injections est déterminé par le protocole choisi (avec une préférence actuelle pour des protocoles dits proactifs), l’agressivité de la maladie et la molécule injectée. L’intervalle minimal est de 4 semaines, l’intervalle maximal étant à 4-5 mois avec les molécules actuelles. D’autres molécules anti-angiogéniques existent sur le marché.
Les anti-VEGF ont une double action : d’une part, ils sont anti-angiogéniques, c’est-à-dire qu’ils stoppent la progression des néovaisseaux, sans pour autant les faire régresser; d’autre part, ils corrigent leur hyperperméabilité, faisant ainsi régresser l’exsudation et donc l’œdème rétinien maculaire.
Sous l’effet du traitement, 40 % des yeux ont une amélioration visuelle substantielle persistante à 2 ans de traitement si celui-ci est bien mené. Dans les autres cas, la vision soit reste stable, soit baisse avec le temps. Moins de 10 % des cas s’aggravent de façon importante, malgré le traitement.
Dans certains cas rares, et en deuxième intention, on peut recourir en complément de traitement à la thérapie photodynamique (PDT). Ce traitement consiste à illuminer la partie du fond d’œil contenant les néovaisseaux choroïdiens avec un laser infrarouge après avoir perfusé par voie intraveineuse un photosensibilisant (la vertéporfine), ce qui entraîne une thrombose des néovaisseaux choroïdiens. Cette technique est actuellement réservée en seconde intention, notamment pour une forme particulaire de type 1 (vasculopathie polypoïdale).
La thérapie génique est actuellement en cours d’évaluation en phase 3 par injection unique sous-rétinienne et pourrait diminuer drastiquement le nombre d’injections d’anti-VEGF à l’avenir.
D La chirurgie
La chirurgie est réservée actuellement au traitement des hématomes maculaires épais et de grande taille.
![]() Elle associe une injection sous-rétinienne de tPA, un tamponnement au gaz pour déplacer l’hématome hors de la macula et une injection intravitréenne d’anti-VEGF. Les alternatives thérapeutiques moins invasives sont en cours d’évaluation dans deux études prospectives.
Elle associe une injection sous-rétinienne de tPA, un tamponnement au gaz pour déplacer l’hématome hors de la macula et une injection intravitréenne d’anti-VEGF. Les alternatives thérapeutiques moins invasives sont en cours d’évaluation dans deux études prospectives.
E Rééducation orthoptique et aides visuelles
![]() Quand les autres traitements n’ont pas permis la conservation d’une acuité visuelle satisfaisante, notamment de près, il faut proposer aux patients une rééducation et des aides visuelles :
Quand les autres traitements n’ont pas permis la conservation d’une acuité visuelle satisfaisante, notamment de près, il faut proposer aux patients une rééducation et des aides visuelles :
Ces techniques ont cependant des limites, et idéalement de nombreux patients devraient être pris en charge par des équipes pluridisciplinaires associant ophtalmologiste, orthoptiste, opticien, ergothérapeute, psychologue et personne chargée des activités de la vie quotidienne, mais de tels centres sont rares en France.
Cela souligne l’importance d’un dépistage précoce, de la connaissance du syndrome maculaire et d’un traitement en urgence de la DMLA exsudative.
 Compléments en ligne
Compléments en ligne
Quels sont les symptômes typiques de la DMLA ?
Quelle est la forme de traitement de première ligne utilisée pour la DMLA exsudative ?
À quelle décade la DMLA est-elle la plus fréquente ? QRU)
Quel(s) examen(s) est (sont) essentiel(s) pour confirmer une DMLA ?
Quelle caractéristique distingue la forme atrophique de la DMLA ?
Quel est le principal facteur de risque de la DMLA ?
Quelle est la différence principale entre la DMLA atrophique et la DMLA néovasculaire ?
 Compléments en ligne
Compléments en ligne
Des compléments numériques sont associés à ce chapitre. Ils sont indiqués dans le texte par un picto. Pour voir ces compléments, connectez-vous sur http://www.em-consulte.com/e-complements/478662 et suivez les instructions.
