CHAPITRE 20: Item 247 Rétinopathie diabétique
Pr C. Creuzot-Garcher, CHU de Dijon
Situations cliniques de départ
La rétinopathie diabétique (RD) peut être évoquée devant les situations cliniques suivantes.
 42 – Hypertension artérielle : c’est un facteur de risque associé au développement de la RD et de l’œdème maculaire.
42 – Hypertension artérielle : c’est un facteur de risque associé au développement de la RD et de l’œdème maculaire.
 138 – Anomalie de la vision : la RD mais surtout l’œdème maculaire diabétique sont responsables d’une baisse de vision (c’est la première cause de cécité chez les patients de moins de 50 ans).
138 – Anomalie de la vision : la RD mais surtout l’œdème maculaire diabétique sont responsables d’une baisse de vision (c’est la première cause de cécité chez les patients de moins de 50 ans).
 143 – Diplopie : le diabète est une des causes de diplopie en raison de la neuropathie diabétique.
143 – Diplopie : le diabète est une des causes de diplopie en raison de la neuropathie diabétique.
 178 – Demande/prescription raisonnée et choix d’un examen diagnostique : pour savoir faire la distinction entre les examens complémentaires très utiles et sans risque pour le suivi de la RD et de l’œdème maculaire (rétinophotographies couleurs et tomographie par cohérence optique [OCT]) et les examens comme l’angiographie fluorescéinique.
178 – Demande/prescription raisonnée et choix d’un examen diagnostique : pour savoir faire la distinction entre les examens complémentaires très utiles et sans risque pour le suivi de la RD et de l’œdème maculaire (rétinophotographies couleurs et tomographie par cohérence optique [OCT]) et les examens comme l’angiographie fluorescéinique.
 195 – Analyse du bilan lipidique : un des facteurs de risque d’aggravation de la RD.
195 – Analyse du bilan lipidique : un des facteurs de risque d’aggravation de la RD.
 208 – Hyperglycémie : un des facteurs de risque associé au développement de la RD et de l’œdème maculaire.
208 – Hyperglycémie : un des facteurs de risque associé au développement de la RD et de l’œdème maculaire.
 279 – Consultation de suivi d’une pathologie chronique : l’examen du fond d’œil chez le diabétique doit être effectué de façon annuelle ou au minimum tous les 2 ans pour les patients sans facteur de risque.
279 – Consultation de suivi d’une pathologie chronique : l’examen du fond d’œil chez le diabétique doit être effectué de façon annuelle ou au minimum tous les 2 ans pour les patients sans facteur de risque.
 328 – Annonce d’une maladie chronique : la RD et l’œdème maculaire vont nécessiter un suivi régulier et des injections intravitréennes à adapter en fonction de la réponse au traitement.
328 – Annonce d’une maladie chronique : la RD et l’œdème maculaire vont nécessiter un suivi régulier et des injections intravitréennes à adapter en fonction de la réponse au traitement.
348Hiérarchisation des connaissances
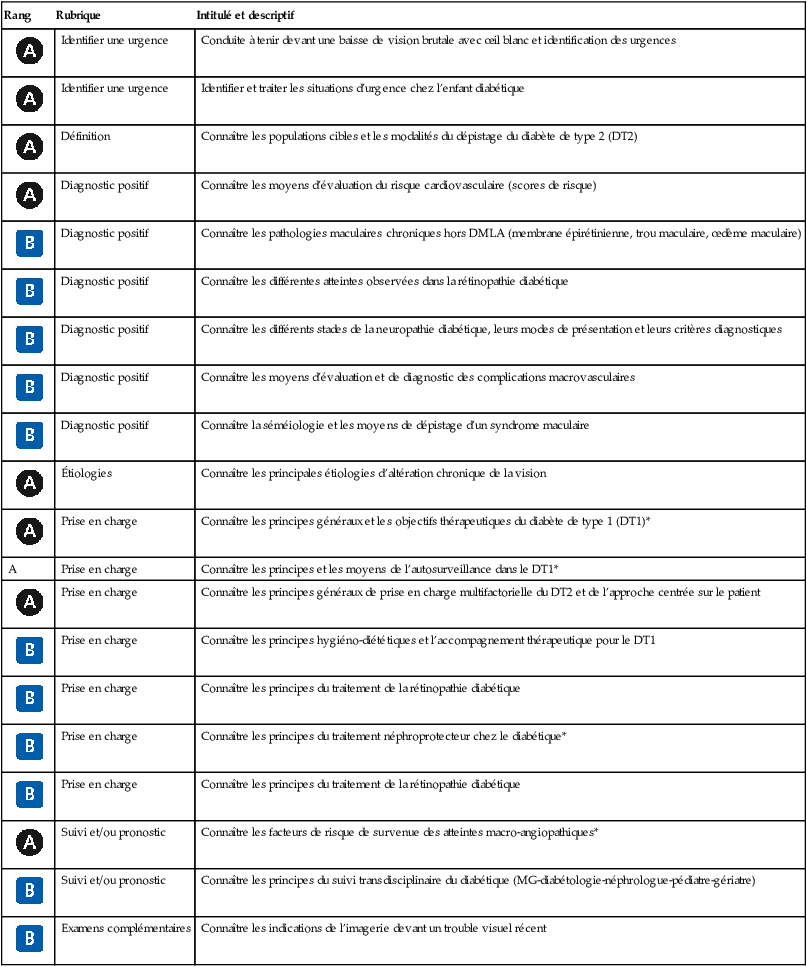
| Rang | Rubrique | Intitulé et descriptif |
|
|
Identifier une urgence | Conduite à tenir devant une baisse de vision brutale avec œil blanc et identification des urgences |
|
|
Identifier une urgence | Identifier et traiter les situations d’urgence chez l’enfant diabétique |
|
|
Définition | Connaître les populations cibles et les modalités du dépistage du diabète de type 2 (DT2) |
|
|
Diagnostic positif | Connaître les moyens d’évaluation du risque cardiovasculaire (scores de risque) |
|
|
Diagnostic positif | Connaître les pathologies maculaires chroniques hors DMLA (membrane épirétinienne, trou maculaire, œdème maculaire) |
|
|
Diagnostic positif | Connaître les différentes atteintes observées dans la rétinopathie diabétique |
|
|
Diagnostic positif | Connaître les différents stades de la neuropathie diabétique, leurs modes de présentation et leurs critères diagnostiques |
|
|
Diagnostic positif | Connaître les moyens d’évaluation et de diagnostic des complications macrovasculaires |
|
|
Diagnostic positif | Connaître la séméiologie et les moyens de dépistage d’un syndrome maculaire |
|
|
Étiologies | Connaître les principales étiologies d’altération chronique de la vision |
|
|
Prise en charge | Connaître les principes généraux et les objectifs thérapeutiques du diabète de type 1 (DT1)* |
| A | Prise en charge | Connaître les principes et les moyens de l’autosurveillance dans le DT1* |
|
|
Prise en charge | Connaître les principes généraux de prise en charge multifactorielle du DT2 et de l’approche centrée sur le patient |
|
|
Prise en charge | Connaître les principes hygiéno-diététiques et l’accompagnement thérapeutique pour le DT1 |
|
|
Prise en charge | Connaître les principes du traitement de la rétinopathie diabétique |
|
|
Prise en charge | Connaître les principes du traitement néphroprotecteur chez le diabétique* |
|
|
Prise en charge | Connaître les principes du traitement de la rétinopathie diabétique |
|
|
Suivi et/ou pronostic | Connaître les facteurs de risque de survenue des atteintes macro-angiopathiques* |
|
|
Suivi et/ou pronostic | Connaître les principes du suivi transdisciplinaire du diabétique (MG-diabétologie-néphrologue-pédiatre-gériatre) |
|
|
Examens complémentaires | Connaître les indications de l’imagerie devant un trouble visuel récent |
I Épidémiologie
![]() De grandes études épidémiologiques ont permis de mieux cerner la prévalence des complications rétiniennes de la rétinopathie diabétique (RD).
De grandes études épidémiologiques ont permis de mieux cerner la prévalence des complications rétiniennes de la rétinopathie diabétique (RD).
On estime qu’environ 30 % des diabétiques sont porteurs d’une rétinopathie, soit environ un million de patients en France.
La rétinopathie diabétique est aussi fréquente au cours du diabète de type 1 qu’au cours du diabète de type 2 :
- • dans le diabète de type 1, la RD ne survient en général pas avant 7 ans d’évolution; après 20 ans d’évolution, 90 % à 95 % des diabétiques de type 1 ont une RD, dont 40 % une RD proliférante;
- • dans le diabète de type 2, 20 % des diabétiques ont une RD dès la découverte de leur diabète. Après 15 ans d’évolution, 60 % d’entre eux ont une RD. Le risque à long terme des diabétiques de type 2 est moins celui d’une rétinopathie proliférante que celui d’un œdème maculaire.
II Physiopathogénie
![]() La RD est une conséquence de l’hyperglycémie chronique.
La RD est une conséquence de l’hyperglycémie chronique. ![]() Les premières lésions histo-logiques de la RD sont l’épaississement de la membrane basale, la perte des péricytes, puis la perte des cellules endothéliales des capillaires rétiniens aboutissant à leur obstruction. À proximité des petits territoires de non-perfusion capillaire ainsi créés, des microanévrismes se développent sur les capillaires de voisinage. La RD inclut également une dégénérescence neuronale rétinienne précoce, pouvant précéder l’apparition de lésions vasculaires au fond d’œil (FO), mise en évidence par des examens électrophysiologiques et participant à la dysfonction rétinienne.
Les premières lésions histo-logiques de la RD sont l’épaississement de la membrane basale, la perte des péricytes, puis la perte des cellules endothéliales des capillaires rétiniens aboutissant à leur obstruction. À proximité des petits territoires de non-perfusion capillaire ainsi créés, des microanévrismes se développent sur les capillaires de voisinage. La RD inclut également une dégénérescence neuronale rétinienne précoce, pouvant précéder l’apparition de lésions vasculaires au fond d’œil (FO), mise en évidence par des examens électrophysiologiques et participant à la dysfonction rétinienne.
De nombreux mécanismes sont impliqués dans la pathogénie de la RD (fig. 20.1) : la voie de l’aldose-réductase réduit le glucose en sorbitol. Elle est minoritaire en situation de nor-moglycémie mais anormalement activée dans l’hyperglycémie. Elle conduit à l’accumulation intracellulaire de sorbitol, alcool toxique pour la cellule. La glycation des protéines (liaison non enzymatique du glucose sur une protéine) entraîne un épaississement des membranes basales et diminue la diffusion en oxygène. Le stress oxydatif, l’activation du système rétine-angiotensine 350et l’inflammation entraînent une modification du flux sanguin rétinien et une hypoxie relative conduisant à la sécrétion locale (par les cellules rétiniennes) de facteurs de croissance angiogé-niques et pro-perméabilisants tels que le VEGF (vascular endothelial growth factor).

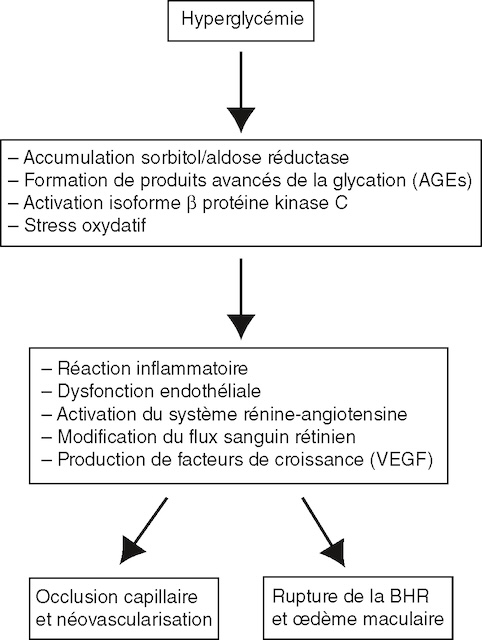
Le schéma montre plusieurs dérèglements en cascade à partir de l’hyperglycémie. On voit quatre voies : accumulation de sorbitol, glycation des protéines, activation de la PKC et stress oxydatif. Ces réactions déclenchent des inflammations locales, perturbent l’endothélium, réduisent le débit capillaire et favorisent la libération de VEGF. Deux conséquences sont représentées : soit une ischémie qui induit une néovascularisation, soit une perte d’étanchéité de la barrière interne avec œdème maculaire. L’ensemble résume les grandes étapes de la progression vers les formes sévères de rétinopathie.
![]() L’hyperperméabilité et l’occlusion des capillaires rétiniens sont les premières lésions clini-quement décelables de la RD, aboutissant à deux phénomènes intriqués : hyperperméabilité capillaire menant à l’œdème rétinien et, parallèlement, occlusion capillaire menant à l’ischémie rétinienne.
L’hyperperméabilité et l’occlusion des capillaires rétiniens sont les premières lésions clini-quement décelables de la RD, aboutissant à deux phénomènes intriqués : hyperperméabilité capillaire menant à l’œdème rétinien et, parallèlement, occlusion capillaire menant à l’ischémie rétinienne. ![]() Les phénomènes occlusifs et œdémateux évoluent de façon concomitante, les phénomènes œdémateux prédominant dans la région centrale de la rétine, la macula, et les phénomènes occlusifs affectant surtout la rétine périphérique.
Les phénomènes occlusifs et œdémateux évoluent de façon concomitante, les phénomènes œdémateux prédominant dans la région centrale de la rétine, la macula, et les phénomènes occlusifs affectant surtout la rétine périphérique.
L’hyperperméabilité des capillaires rétiniens au niveau de la macula entraîne un passage anormal de liquide plasmatique dans le tissu rétinien, matérialisé par la diffusion de colorant en angiographie à la fluorescéine. Elle aboutit à la constitution d’un œdème maculaire entraînant un épaississement de la rétine maculaire mesurable sur l’OCT. La précipitation de lipoprotéines plasmatiques dans l’épaisseur de la rétine entraîne la formation d’exsudats lipidiques dans la macula. L’hyperperméabilité capillaire est accentuée par la production en excès de VEGF.
L‘occlusion des capillaires rétiniens est l’autre aspect de l’atteinte vasculaire de la RD. Lorsque l’occlusion capillaire est étendue, l’hypoxie entraîne une production réactionnelle de facteurs de croissance, comme le VEGF par les cellules rétiniennes, qui induit une prolifération de néovaisseaux : c’est la RD proliférante.
III Diagnostic
![]() La baisse d’acuité visuelle ne survient qu’après une longue période d’évolution de la RD. Elle est due aux complications néovasculaires ou à l’œdème maculaire. La RD est donc une affection longtemps silencieuse qui ne sera détectée que par un examen systématique du FO.
La baisse d’acuité visuelle ne survient qu’après une longue période d’évolution de la RD. Elle est due aux complications néovasculaires ou à l’œdème maculaire. La RD est donc une affection longtemps silencieuse qui ne sera détectée que par un examen systématique du FO.
351![]() La RD devrait être dépistée précocement, avant la survenue de complications, par l’examen ophtalmologique réalisé systématiquement lors de la découverte du diabète ou lors de la surveillance ophtalmologique annuelle de tout diabétique.
La RD devrait être dépistée précocement, avant la survenue de complications, par l’examen ophtalmologique réalisé systématiquement lors de la découverte du diabète ou lors de la surveillance ophtalmologique annuelle de tout diabétique.
B Diagnostic de la rétinopathie diabétique
![]() Le diagnostic de la RD repose sur l’examen du FO. La dilatation pupillaire peut être évitée et souvent remplacée par des rétinophotographies couleur du FO (qui peuvent être faites sans dilatation), qui permettent une analyse plus précise des lésions rétiniennes que le simple FO, surtout quand elles sont débutantes. Le suivi passe également par cet examen fait avec dilatation pour définir précisément l’étendue des lésions. Les rétinophotographies permettent un suivi plus précis. Cet examen permet d’identifier les différents signes de la RD :
Le diagnostic de la RD repose sur l’examen du FO. La dilatation pupillaire peut être évitée et souvent remplacée par des rétinophotographies couleur du FO (qui peuvent être faites sans dilatation), qui permettent une analyse plus précise des lésions rétiniennes que le simple FO, surtout quand elles sont débutantes. Le suivi passe également par cet examen fait avec dilatation pour définir précisément l’étendue des lésions. Les rétinophotographies permettent un suivi plus précis. Cet examen permet d’identifier les différents signes de la RD :
- • les microanévrismes rétiniens sont les premiers signes de la RD. Il s’agit de dilatations capillaires, punctiformes, rouges qui prédominent au pôle postérieur du FO. Au cours de l’évolution spontanée de la RD, certains microanévrismes s’occluent spontanément et d’autres apparaissent. Les occlusions capillaires associées aux microanévrismes sont bien visibles en OCT-angiographie (fig. 20.2). L’augmentation globale du nombre des microanévrismes est un bon indice de progression de la RD;

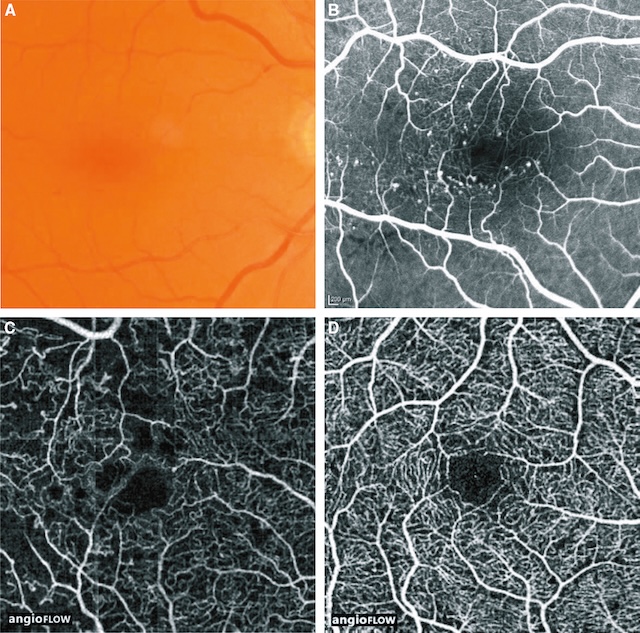
Fig. 20.2 Rétinopathie diabétique.
A. Présence de microanévrismes et d’hémorragies punctiformes au pôle postérieur : à l’examen du fond d’œil, les microanévrismes apparaissent comme de petites lésions punctiformes, rouges, à la limite de la visibilité. B. Les microanévrismes sont bien visibles en angiographie à la fluorescéine. C, D. Réseau capillaire dans la macula au cours d’une rétinopathie diabétique en OCT-angiographie (C). Noter les nombreux capillaires occlus en comparaison d’un sujet normal (D).Sur l’image A, le fond d’œil en couleur montre une zone maculaire d’apparence relativement calme, sans exsudats ni hémorragies flagrantes, bien que la vascularisation semble discrètement altérée. L’image B, en angiographie à la fluorescéine, révèle une hypoperfusion au centre de la macula avec des microanévrysmes dispersés et un réseau capillaire irrégulier. Les images C et D en OCT-angiographie (angioFLOW) mettent en évidence une raréfaction marquée des capillaires au niveau du plexus superficiel et profond, formant une zone d’ischémie centrale bien délimitée. L’architecture vasculaire périphérique reste visible, mais désorganisée autour de la fovéa.
- • les hémorragies rétiniennes punctiformes peuvent être associées aux microanévrismes;
- • les nodules cotonneux (qui ne sont pas spécifiques à la RD) sont de petits foyers blancs d’infarctus localisé de la rétine interne (fig. 20.3). Ils siègent au pôle postérieur du FO. Si leur localisation est péripapillaire, on doit suspecter des poussées d‘hypertension artérielle associées (70 % des diabétiques de type 2 sont hypertendus et peuvent donc présenter au FO des lésions mixtes de RD et de rétinopathie hypertensive);

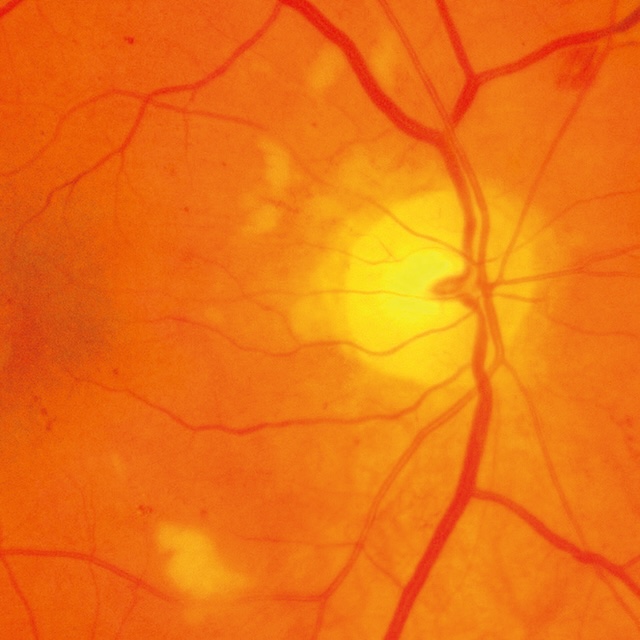
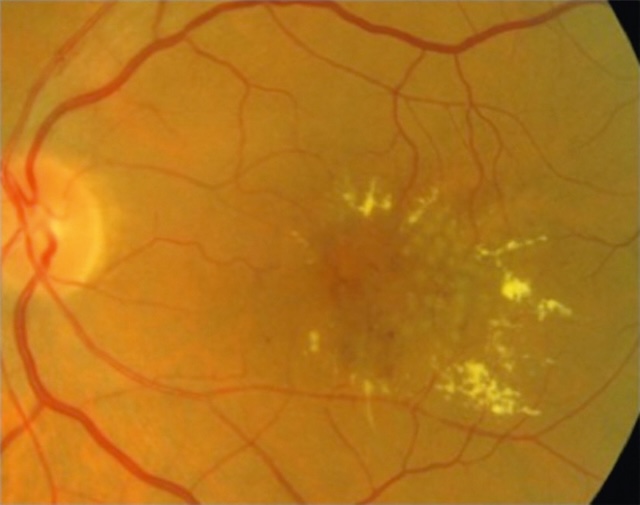
Fig. 20.3 Nodule cotonneux. Cette photographie couleur du fond d’œil révèle un nodule cotonneux bien visible situé légèrement supérieur et temporal au disque optique. Cette lésion blanchâtre, floue, à bords mal définis, s’inscrit dans l’épaisseur de la rétine et témoigne d’une ischémie des fibres nerveuses. Elle est accompagnée de rares hémorragies intrarétiniennes ponctuelles et linéaires, plus diffuses dans les quadrants inférieurs. La papille optique apparaît bien nette, sans œdème, et la vascularisation centrale est conservée. L’ensemble évoque un contexte vasculaire perturbé, souvent observé dans les atteintes microangiopathiques comme la rétinopathie diabétique ou hypertensive.
- • d’autres signes sont évocateurs de l’occlusion capillaire (ischémie) rétinienne compliquant la RD :
- – les hémorragies intrarétiniennes « en taches » sont le témoin d’une occlusion capillaire récente en périphérie rétinienne (fig. 20.4 et fig. 20.5),

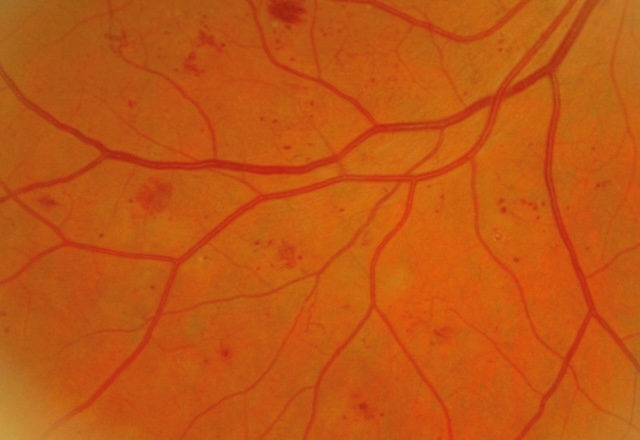
Fig. 20.4 Hémorragies en taches et anomalie microvasculaire intrarétinienne (AMIR). Sur cette photographie du fond d’œil, on distingue nettement plusieurs hémorragies rétiniennes en taches, disséminées principalement dans la moitié supérieure et temporale de l’image. Elles apparaissent sous forme de foyers rouges irréguliers, intrarétiniens, évoquant une souffrance vasculaire. À côté, on observe des anomalies microvasculaires intrarétiniennes (AMIR), identifiables par des trajets capillaires dilatés et sinueux, témoignant d’une réponse à l’ischémie rétinienne. La structure artérioveineuse reste globalement conservée, mais le lit capillaire montre des altérations marquées. Cet aspect s’intègre dans un tableau typique de rétinopathie diabétique non proliférante modérée.

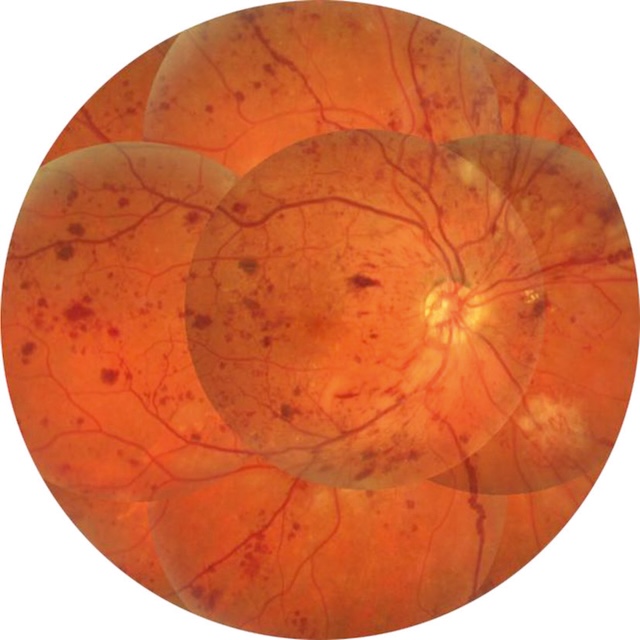
Fig. 20.5 Rétinopathie diabétique non proliférante sévère : nombreuses hémorragies en taches sur toute la périphérie. Cette image montre un fond d’œil typique d’une rétinopathie diabétique non proliférante sévère. On observe une multitude d’hémorragies en taches réparties de manière diffuse sur l’ensemble du champ rétinien, y compris la périphérie. Les hémorragies, de formes et tailles variées, apparaissent sombres et arrondies, traduisant une atteinte vasculaire étendue. Le disque optique reste relativement net, sans signe de néovascularisation. L’arrière-plan rétinien présente une pigmentation régulière mais parsemée de microanévrismes et d’éventuelles exsudats durs mal délimités. Cet aspect traduit une hypoxie significative du tissu rétinien avec un risque évolutif vers une forme proliférante.
- – des hémorragies en flammèches évoquent une rétinopathie hypertensive associée,
- – des anomalies microvasculaires intrarétiniennes (AMIR) sont des proliférations capillaires intrarétiniennes développées autour des territoires d’occlusion capillaire (voir fig. 20.4),
- – des dilatations veineuses irrégulières « en chapelet » ou des boucles veineuses s’observent en bordure de larges territoires d’occlusion capillaire (ischémie),
- – des néovaisseaux prérétiniens et prépapillaires caractérisent la RD proliférante (fig. 20.6 et fig. 20.7). Ils prolifèrent à la limite postérieure des territoires ischémiques ou sur le nerf optique lorsque la surface de rétine non perfusée est très étendue (fig. 20.8),

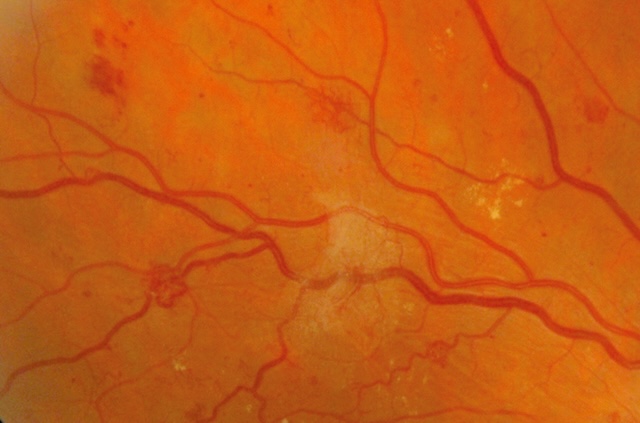
Fig. 20.6 Néovaisseaux prérétiniens. L’image met en évidence des néovaisseaux prérétiniens caractérisés par de fines structures vasculaires anormalement tortueuses, visibles à la surface de la rétine. Ces vaisseaux apparaissent en relief, souvent arborisés, et se distinguent nettement des réseaux vasculaires normaux. Ils semblent émerger dans une zone centrale irrégulièrement blanchâtre, où des exsudats lipidiques et hémorragies ponctuées peuvent également être notés. La topographie suggère une activité ischémique intense en arrière-plan, classique d’une rétinopathie diabétique proliférante, marquée par une prolifération vasculaire pathologique menaçant la structure rétinienne.

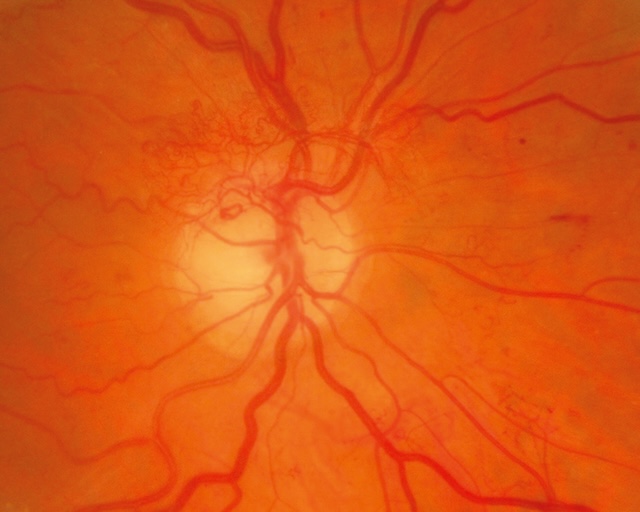
Fig. 20.7 Néovaisseaux prépapillaires. L’image montre un fond d’œil avec une papille optique bien dégagée, autour de laquelle s’étendent des néovaisseaux prépapillaires à disposition anarchique. Ces vaisseaux anormaux forment un réseau dense et désorganisé, émergeant directement de la tête du nerf optique. Leur apparence fine et arborisée contraste avec les vaisseaux rétiniens normaux, bien calibrés. On note également des petites hémorragies rétiniennes disséminées, témoignant d’une activité vasculaire proliférative. Ce type de néovascularisation traduit une réponse ischémique avancée, typique d’une rétinopathie diabétique proliférante sévère.

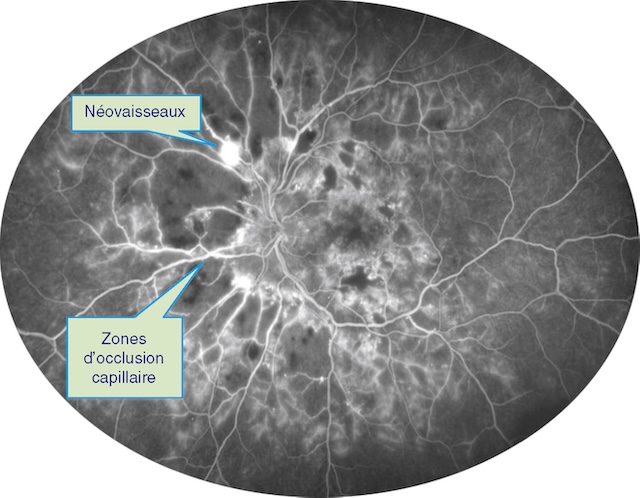
Fig. 20.8 Angiographie à la fluorescéine d’une rétinopathie diabétique proliférante avec des néovaisseaux prérétiniens (laissant diffuser la fluorescéine) en bordure de territoires d’occlusion capillaire. Cette angiographie à la fluorescéine met en évidence une rétinopathie diabétique proliférante active. Au centre, de vastes zones d’occlusion capillaire apparaissent comme des régions sombres, sans perfusion, traduisant une ischémie rétinienne sévère. En périphérie de ces zones, on observe des néovaisseaux prérétiniens hyperfluorescents, brillamment marqués par une fuite de fluorescéine, soulignant leur activité. Ces néovaisseaux, fins et anarchiques, émergent à proximité des territoires ischémiques, selon le schéma typique de la réponse vasoproliférative à l’hypoxie rétinienne. L’image illustre un stade avancé nécessitant une prise en charge urgente.
- – des anomalies macrovasculaires ou des néovaisseaux périphériques,
- – des hémorragies prérétiniennes ou intravitréennes surviennent à partir des néovaisseaux (fig. 20.9).

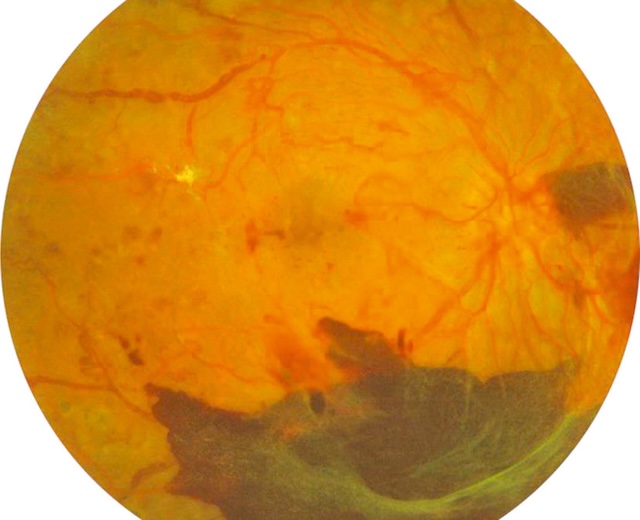
Fig. 20.9 Rétinopathie diabétique proliférante avec hémorragies prérétiniennes. L’image montre un fond d’œil typique d’une rétinopathie diabétique proliférante compliquée. Dans la partie inférieure, une large hémorragie prérétinienne s’étale en nappe, d’aspect sombre et dense, masquant partiellement les structures vasculaires sous-jacentes. On distingue en périphérie de fines tractions fibrovasculaires blanchâtres, traduisant l’organisation de néovaisseaux anciens. Les vaisseaux rétiniens sont tortueux, parfois dilatés, avec un fond d’œil diffusément altéré. Un discret œdème maculaire est aussi visible plus en arrière-plan. Ce tableau traduit une forme avancée de la pathologie, à risque élevé de complications comme un décollement tractionnel de la rétine.
- – les hémorragies intrarétiniennes « en taches » sont le témoin d’une occlusion capillaire récente en périphérie rétinienne (fig. 20.4 et fig. 20.5),
Des complications peuvent survenir :
- • hémorragie intravitréenne par saignement des néovaisseaux prérétiniens ou prépapillaires;
- • décollement de la rétine dû à la traction exercée sur la rétine par le tissu fibreux de soutien des néovaisseaux (prolifération fibrovasculaire) : on parle de décollement de rétine par traction (fig. 20.10) par opposition au décollement de rétine rhegmatogène induit primitivement par une déchirure de la rétine;

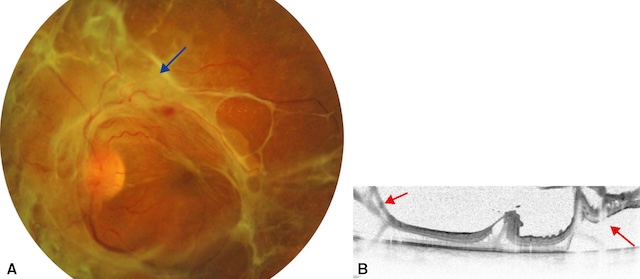
Fig. 20.10 A. Retinopathie diabétique proliférante avec fibrose prérétinienne (flèche bleue). B. Décollement de rétine tractionnel (flèche rouges), bien visible en OCT. Sur l’image A, un fond d’œil révèle une rétinopathie diabétique proliférante marquée par une fibrose prérétinienne épaisse et blanchâtre s’étendant en arc autour de la papille et de la macula. La traction générée par ces membranes fibrovasculaires est évidente, avec des plis rétiniens radiaires et un soulèvement localisé de la rétine. L’image B, en OCT, confirme un décollement de rétine de type tractionnel : la rétine est soulevée sans espace sous-rétinien liquidien net, et les insertions des tractions sont visibles de part et d’autre, souvent à proximité des néovaisseaux. L’ensemble témoigne d’un stade avancé de complication diabétique nécessitant une prise en charge chirurgicale.
- • néovascularisation irienne (prolifération de néovaisseaux sur l’iris et dans l’angle iridocor-néen) pouvant provoquer un glaucome néovasculaire par blocage de l’écoulement de l’humeur aqueuse (fig. 20.11).

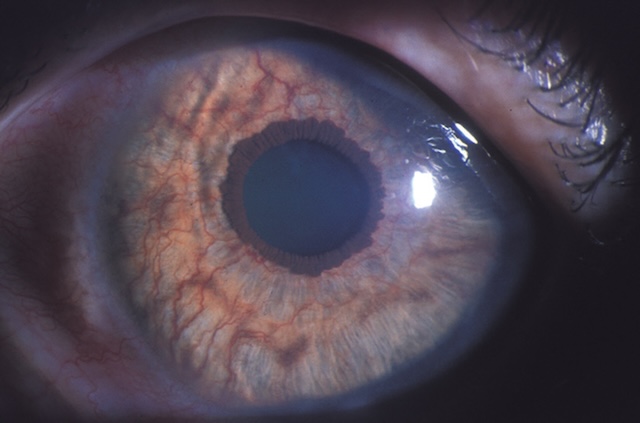
Fig. 20.11 Néovascularisation irienne : présence de néovaisseaux sur la face antérieure de l’iris. L’image montre un œil en éclairage focalisé révélant clairement une néovascularisation irienne. De fins vaisseaux anormaux se dessinent à la surface antérieure de l’iris, organisés de façon anarchique autour de la pupille et sur le stroma irien. Ces néovaisseaux sont bien visibles, serpentant à travers la texture finement pigmentée de l’iris clair. La zone péripupillaire est particulièrement marquée, sans signe de réaction inflammatoire apparente ni d'hypopion. Ce type de néovascularisation évoque une réponse ischémique souvent secondaire à une rétinopathie proliférante ou à une occlusion veineuse sévère.
352D’autres signes sont évocateurs de l’hyperperméabilité capillaire au niveau de la macula :
- • un œdème maculaire qui se traduit par un épaississement de la rétine maculaire détectable en OCT. L’œdème est dit cystoïde (œdème maculaire cystoïde [OMC]) lorsqu’il existe un épaississement microkystique de la rétine maculaire (fig. 20.12);

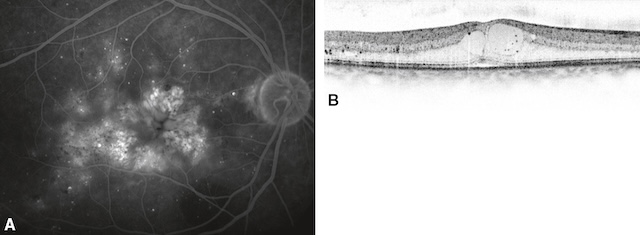
Fig. 20.12 œdème maculaire cystoïde sévère.
A. En angiographie à la fluorescéine, accumulation de colorant dans des logettes cystoïdes étendues à toute la surface de la macula. B. L’OCT montre l’épaississement microkystique rétinien maculaire.L’image A présente une angiographie à la fluorescéine montrant une hyperfluorescence diffuse et intense centrée sur la macula, avec des dépôts lipidiques visibles en couronne évoquant une perméabilité vasculaire marquée. Des microanévrismes et de fins vaisseaux fuyants structurent un tableau typique d’œdème maculaire cystoïde sévère. L’image B, en coupe OCT, confirme cet aspect avec plusieurs cavités hyporéflectives intrarétiniennes bien délimitées, traduisant un œdème organisé. L’architecture fovéale est altérée, mais le contour rétinien reste intact, sans traction évidente. L’épaississement rétinien est net, confirmant un stade avancé de la pathologie.
- • des exsudats lipidiques qui sont des accumulations de lipoprotéines dans l’épaisseur de la rétine œdématiée. Ils forment des dépôts jaunes, souvent disposés en couronne autour des anomalies microvasculaires dont ils proviennent (exsudats circinés) (fig. 20.13).

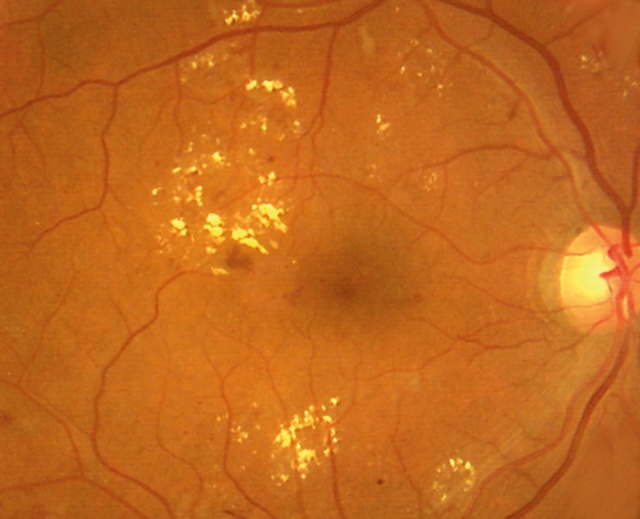
Fig. 20.13 œdème maculaire associé à des exsudats lipidiques. Sur cette rétinophotographie en couleur, on observe un œdème maculaire caractérisé par une zone centrale sombre et floue au niveau de la macula, traduisant une accumulation de liquide intrarétinien. Autour de cette zone, plusieurs dépôts jaunes bien définis forment des exsudats lipidiques disposés en couronne, notamment au pôle supérieur et inférieur. Ces dépôts sont le signe d’une fuite chronique de fluides lipidiques à partir de capillaires rétiniens perméables. La papille optique, à droite, conserve un contour net et une coloration physiologique. Le réseau vasculaire reste structuré, sans dilatation excessive ni anomalie apparente dans les vaisseaux de premier ordre.
C 353354355356Examens complémentaires
La photographie du FO avec dilatation est la base des classifications de la RD. Des photographies du pôle postérieur et de la moyenne périphérie sont réalisées. Elles permettent de visualiser les différents signes de la RD et d’évaluer indirectement l’ischémie rétinienne périphérique. ![]() En effet, la gravité de celle-ci est estimée par le nombre et l’étendue de certaines anomalies cliniques (hémorragies intrarétiniennes « en taches », dilatation veineuse, AMIR).
En effet, la gravité de celle-ci est estimée par le nombre et l’étendue de certaines anomalies cliniques (hémorragies intrarétiniennes « en taches », dilatation veineuse, AMIR).
![]() La photographie du FO est également utilisée pour le dépistage de la RD, le plus souvent sans dilatation, chez les patients sans RD connue.
La photographie du FO est également utilisée pour le dépistage de la RD, le plus souvent sans dilatation, chez les patients sans RD connue. ![]() Les photographies peuvent être prises sans (ou avec) dilatation pupillaire par des techniciens non-médecins, à l’aide d’un rétino-graphe couleur.
Les photographies peuvent être prises sans (ou avec) dilatation pupillaire par des techniciens non-médecins, à l’aide d’un rétino-graphe couleur.
Cette méthode a une sensibilité nettement supérieure à celle du simple examen ophtalmo-scopique pour dépister la RD. La Haute autorité de santé (HAS) recommande depuis 2007, comme examen de référence et en première intention, la réalisation de photographies du FO pour dépister la RD. Des rétinographes ultra-grand champ sont en train de se développer; ils permettent, à partir d’un seul cliché, de voir de 120 à 210° de la surface de la rétine, surtout si le patient est dilaté. L’analyse précise des lésions reste encore un peu limitée, mais il est assez probable qu’à terme ils remplaceront les rétinographes classiques (fig. 20.14A,B).

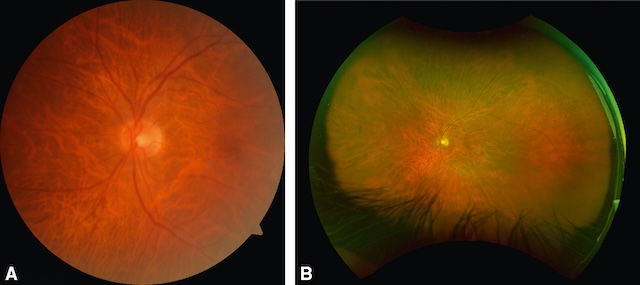
A. Clichés couleur obtenus par rétinographe non mydriatique centrés sur la macula et sur la papille. B. Aspect obtenu chez le même patient en rétinographe très grand champ.
Les deux rétinophotographies illustrent des vues centrées sur la papille optique et la macula. L’image A montre un fond d’œil très rouge orangé avec une vascularisation radiaire dense, marquée par une hypermyélinisation des fibres nerveuses. La papille est bien centrée, légèrement pâle, avec des vaisseaux rétiniens fins mais très nombreux. Sur l’image B, prise en champ ultra-large, la rétine périphérique est visible avec une distribution vasculaire dense qui rayonne depuis la papille. Aucune lésion hémorragique ou exsudative n’est présente, mais la densité inhabituelle du réseau vasculaire attire l’attention, évoquant une anomalie congénitale ou un développement vasculaire exubérant.
2 357Tomographie en cohérence optique
![]() Voir chapitre 1.
Voir chapitre 1.
![]() L’OCT est essentielle pour le diagnostic et le suivi de l’œdème maculaire par l’obtention de coupes de la macula permettant d’identifier l’œdème maculaire, de mesurer son épaisseur et de mieux identifier les compartiments liquidiens dans la rétine.
L’OCT est essentielle pour le diagnostic et le suivi de l’œdème maculaire par l’obtention de coupes de la macula permettant d’identifier l’œdème maculaire, de mesurer son épaisseur et de mieux identifier les compartiments liquidiens dans la rétine. ![]() L’évolution des logiciels a permis la visualisation des capillaires rétiniens sans avoir recours à une injection de colorant sur des coupes « en face » d’OCT (OCT-angiographie; voir fig. 20.2). L’OCT-angiographie permet d’identifier sans injection l’ischémie maculaire par un élargissement de la zone avasculaire centrale. Les signes d’atteinte de la microvascularisation en OCT-angiographie précéderaient l’apparition d’une RD.
L’évolution des logiciels a permis la visualisation des capillaires rétiniens sans avoir recours à une injection de colorant sur des coupes « en face » d’OCT (OCT-angiographie; voir fig. 20.2). L’OCT-angiographie permet d’identifier sans injection l’ischémie maculaire par un élargissement de la zone avasculaire centrale. Les signes d’atteinte de la microvascularisation en OCT-angiographie précéderaient l’apparition d’une RD.
3 Angiographie fluorescéinique
![]() Voir chapitre 1.
Voir chapitre 1.
![]() L’angiographie à la fluorescéine peut être un complément intéressant de l’examen et de la photographie du FO. Elle n’est pas demandée de façon systématique.
L’angiographie à la fluorescéine peut être un complément intéressant de l’examen et de la photographie du FO. Elle n’est pas demandée de façon systématique. ![]() Elle facilite l’identification des territoires ischémiques périphériques et d’éventuels néovaisseaux; elle est également un support incontournable au traitement par photocoagulation au laser des œdèmes maculaires. Elle permet de déceler une hyperperméabilité capillaire (diffusion de colorant) et d’apprécier l’existence de territoires d’occlusion capillaire rétiniens. Elle évalue également le degré d’ischémie maculaire, même si l’OCT-angiographie tend à la supplanter.
Elle facilite l’identification des territoires ischémiques périphériques et d’éventuels néovaisseaux; elle est également un support incontournable au traitement par photocoagulation au laser des œdèmes maculaires. Elle permet de déceler une hyperperméabilité capillaire (diffusion de colorant) et d’apprécier l’existence de territoires d’occlusion capillaire rétiniens. Elle évalue également le degré d’ischémie maculaire, même si l’OCT-angiographie tend à la supplanter.
D 358Classification de la rétinopathie diabétique
![]() La classification de la RD est établie à partir de l’analyse des rétinophographies couleur en fonction du risque visuel lié à la sévérité de l’ischémie rétinienne (encadré 20.1).
La classification de la RD est établie à partir de l’analyse des rétinophographies couleur en fonction du risque visuel lié à la sévérité de l’ischémie rétinienne (encadré 20.1). ![]() Elle débute par les stades de RD non proliférante, successivement minime puis modérée et sévère. Cette dernière est caractérisée par une ischémie rétinienne étendue (avec un risque d’aggravation à 1 an vers la RD proliférante de 50 %) et constitue un tournant dans l’évolution de la RD avec passage vers le stade de RD proliférante, caractérisée par la prolifération de néovaisseaux à la surface de la rétine et/ou sur la papille. Ces derniers peuvent saigner ou entraîner un décollement de rétine par traction.
Elle débute par les stades de RD non proliférante, successivement minime puis modérée et sévère. Cette dernière est caractérisée par une ischémie rétinienne étendue (avec un risque d’aggravation à 1 an vers la RD proliférante de 50 %) et constitue un tournant dans l’évolution de la RD avec passage vers le stade de RD proliférante, caractérisée par la prolifération de néovaisseaux à la surface de la rétine et/ou sur la papille. Ces derniers peuvent saigner ou entraîner un décollement de rétine par traction.
L’œdème maculaire peut s’associer à tous les stades de RD. Cependant, son incidence augmente avec la sévérité de la rétinopathie.
E Modalités de dépistage et de surveillance
![]() Le dépistage de la RD doit concerner tous les diabétiques. Un large consensus existe pour recommander une surveillance annuelle du FO de tout patient diabétique, de préférence par photographies du FO (qui peuvent alors être faites par rétinographes non mydriatiques sans dilatation).
Le dépistage de la RD doit concerner tous les diabétiques. Un large consensus existe pour recommander une surveillance annuelle du FO de tout patient diabétique, de préférence par photographies du FO (qui peuvent alors être faites par rétinographes non mydriatiques sans dilatation). ![]() À défaut, l’examen du FO au biomicroscope (lampe à fente) avec dilatation pupillaire donne des résultats équivalents.
À défaut, l’examen du FO au biomicroscope (lampe à fente) avec dilatation pupillaire donne des résultats équivalents.
![]() Chez un diabétique de type 1, le début du diabète est connu avec précision. La RD ne survient en général pas avant 7 ans d’évolution pour un diabète apparu chez l’enfant : il n’est donc pas nécessaire que le premier examen ophtalmologique soit réalisé avant l’âge de 10 ans.
Chez un diabétique de type 1, le début du diabète est connu avec précision. La RD ne survient en général pas avant 7 ans d’évolution pour un diabète apparu chez l’enfant : il n’est donc pas nécessaire que le premier examen ophtalmologique soit réalisé avant l’âge de 10 ans.
359Si un diabète de type 1 est découvert chez un adulte, la RD n’apparaîtra pas avant 3 ans d’évolution mais un examen du FO par rétinophotographies est souvent réalisé lors de à la découverte du diabète – il servira d’examen de référence –, puis sera répété de façon annuelle.
Chez un diabétique de type 2, le dépistage de la RD doit être réalisé dès la découverte du diabète car le début du diabète est difficile à préciser et une RD est présente dans 20 % des cas à la découverte du diabète.
Au cours de la grossesse, un examen du FO est nécessaire avant celle-ci si elle est programmée, sinon en début de grossesse. En l’absence de RD, une surveillance est effectuée tous les 3 mois. En présence d’une RD, la surveillance a lieu tous les mois, surtout si la grossesse n’a pas été programmée. À noter qu’il est inutile de surveiller le FO d’une patiente présentant un diabète gestationnel, car il n’existe en théorie aucun risque de développer une RD. En revanche, le fait de présenter un diabète gestationnel expose au risque de développer un diabète ultérieurement (50 % à 10 ans). Il ne faut bien entendu pas confondre diabète gestationnel et diabète réel découvert lors de la grossesse.
2 Surveillance
![]() Le rythme de surveillance ophtalmologique des diabétiques dépend de la sévérité de la RD. La surveillance a pour but de mettre en œuvre un traitement éventuel (photocoagulation au laser, injections intraoculaires d’anti-VEGF) avant que ne survienne une baisse d’acuité visuelle irréversible :
Le rythme de surveillance ophtalmologique des diabétiques dépend de la sévérité de la RD. La surveillance a pour but de mettre en œuvre un traitement éventuel (photocoagulation au laser, injections intraoculaires d’anti-VEGF) avant que ne survienne une baisse d’acuité visuelle irréversible :
Ce rythme peut être élargi à 2 ans en cas de diabète bien équilibré et d’absence de situation à risque.
![]() La surveillance doit être renforcée, quel que soit le stade de la rétinopathie, même minime, lorsqu’il existe une situation à risque d’évolution rapide de la RD :
La surveillance doit être renforcée, quel que soit le stade de la rétinopathie, même minime, lorsqu’il existe une situation à risque d’évolution rapide de la RD :
- • au cours de la puberté et de l‘adolescence : c’est une période à haut risque d’évolution, particulièrement entre 16 et 20 ans, surtout si le diabète est instable et si les patients sont moins observants;
- • dans différentes circonstances : en cas d’une équilibration trop rapide de la glycémie (mise sous pompe à insuline ou injections multiples d’insuline, greffe d’îlots de pancréas pour les diabétiques de type 1, ou mise sous insuline pour les diabétiques de type 2); la chirurgie bariatrique, du fait de la perte de poids très rapide qu’elle engendre, représente également un facteur de risque d’évolutivité rapide de la RD; si le diabète est ancien et mal équilibré, s’il existe une RD, un contrôle ophtalmologique tous les 3 à 6 mois est nécessaire;
- • en cas de chirurgie de la cataracte : elle expose à un risque de progression de la RD durant l’année postopératoire : l’idéal est donc de n’opérer un patient de sa cataracte que quand la RD est bien stabilisée et traitée;
- • en cas d’œdème maculaire : une surveillance est effectuée tous les 4 mois, car la chirurgie de la cataracte aggrave l’œdème maculaire. On est souvent amené à traiter cet œdème en peropératoire par injection intravitréenne.
IV Évolution
![]() La RD progresse lentement tout au long de la vie du diabétique, mais peut être marquée par des épisodes d’aggravation rapide.
La RD progresse lentement tout au long de la vie du diabétique, mais peut être marquée par des épisodes d’aggravation rapide.
360La baisse visuelle liée à l’œdème maculaire est lente, mais peut finir par être très handicapante. L’œdème maculaire peut se majorer en cas de déséquilibre du diabète, d’insuffisance rénale, ou de poussée hypertensive.
La prolifération néovasculaire, si elle n’était pas traitée efficacement, peut entraîner rapidement la cécité par ses complications (décollement de rétine tractionnel et glaucome néovasculaire).
V Traitement
1 Équilibre glycémique et tensionnel – primordial
L’effet bénéfique chez les diabétiques de type 1 d’une bonne équilibration glycémique sur l’incidence et la progression de la RD a été démontré par le Diabetic Control and Complications Trial Research Group.
L’effet bénéfique chez les diabétiques de type 2 d’un équilibre glycémique strict, mais aussi du contrôle de la tension artérielle est également démontré par l’étude United Kingdom Prospective Diabetes Study (UKPDS), même si cela n’a pas été démontré dans d’autres études. Les chiffres à atteindre sont une HBA1c de moins de 7,5 % et une pression artérielle en deçà de 130/80 mmHg. Il est toutefois préférable d’effectuer la rééquilibration glycémique de façon progressive pour éviter l’aggravation des signes de RD (particulièrement lors des mises sous pompe à insuline).
B Traitement de la rétinopathie diabétique proliférante
![]() La photocoagulation panrétinienne (PPR) (fig. 20.15) au laser est le traitement spécifique de la RD proliférante. Elle consiste à délivrer des impacts de laser de façon disséminée sur toute la rétine périphérique en épargnant la région centrale.
La photocoagulation panrétinienne (PPR) (fig. 20.15) au laser est le traitement spécifique de la RD proliférante. Elle consiste à délivrer des impacts de laser de façon disséminée sur toute la rétine périphérique en épargnant la région centrale. ![]() Elle n’agit pas directement sur les néovaisseaux mais indirectement par la destruction étendue des territoires de rétine ischémique. La régression de la néovascularisation prérétinienne et/ou prépapillaire est obtenue dans près de 90 % des cas et réduit considérablement le risque de cécité lié à la RD proliférante.
Elle n’agit pas directement sur les néovaisseaux mais indirectement par la destruction étendue des territoires de rétine ischémique. La régression de la néovascularisation prérétinienne et/ou prépapillaire est obtenue dans près de 90 % des cas et réduit considérablement le risque de cécité lié à la RD proliférante.

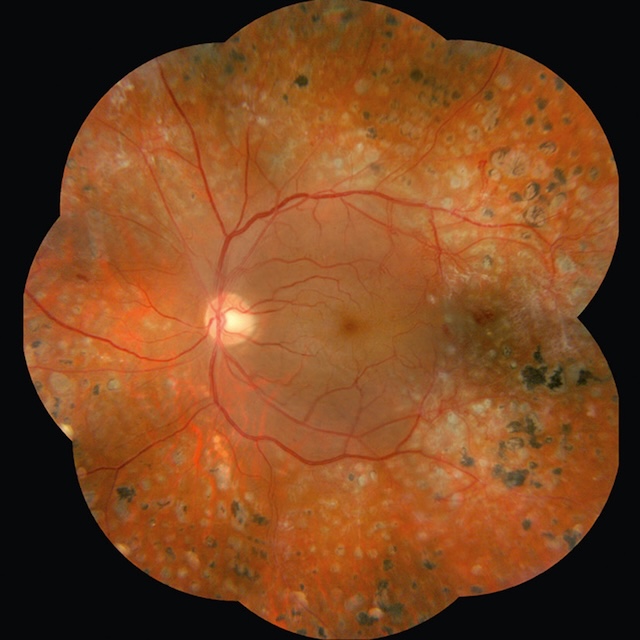
Les cicatrices de laser sont bien visibles sur toute la périphérie du fond d’œil.
Cette rétinophotographie montre un fond d’œil très marqué par une photocoagulation panrétinienne. De multiples cicatrices blanchâtres sont réparties de manière diffuse sur l’ensemble de la périphérie rétinienne, formant un motif quasi circulaire autour du pôle postérieur. La papille est claire et bien définie, tandis que les vaisseaux rétiniens conservent un calibre normal. La macula paraît épargnée, avec une pigmentation centrale légèrement altérée. Ces lésions périphériques correspondent à des impacts de laser, utilisés pour traiter une rétinopathie proliférante menaçante. L’uniformité des marques témoigne d’un traitement bien réalisé, sans signes d’inflammation active ni hémorragies.
La PPR est réalisée en consultation avec une simple anesthésie cornéenne par collyre, en plusieurs séances.
- • dans tous les cas de RD proliférante;
- • dans certains cas de RD non proliférante sévère, à titre préventif, chez des sujets à haut risque de passage en rétinopathie proliférante :
 principalement grossesse, sujet jeune diabétique de type 1 avec normalisation rapide de la glycémie (notamment par mise sous pompe à insuline), chirurgie de la cataracte. La PPR prévient efficacement dans ces cas la survenue d’une néovascularisation. Cette situation devient toutefois moins fréquente grâce aux anti-VEGF dont l’administration peut s’accompagner d’une régression au moins provisoire de la RD.
principalement grossesse, sujet jeune diabétique de type 1 avec normalisation rapide de la glycémie (notamment par mise sous pompe à insuline), chirurgie de la cataracte. La PPR prévient efficacement dans ces cas la survenue d’une néovascularisation. Cette situation devient toutefois moins fréquente grâce aux anti-VEGF dont l’administration peut s’accompagner d’une régression au moins provisoire de la RD.
2 Injections intravitréennes d’anti-VEGF
![]() Des injections intravitréennes d’anti-VEGF (bévacizumab, ranibizumab ou aflibercept) ont, par leur pouvoir anti-angiogénique, un intérêt dans certaines indications de RD proliférante.
Des injections intravitréennes d’anti-VEGF (bévacizumab, ranibizumab ou aflibercept) ont, par leur pouvoir anti-angiogénique, un intérêt dans certaines indications de RD proliférante.
![]() Une étude prospective a montré qu’elles pouvaient prévenir ou faire régresser la néovascu-larisation prérétinienne ou prépapillaire. Cependant, ce traitement n’est que suspensif (en comparaison de la PPR) dans le traitement de la RD proliférante dont le traitement reste la PPR par laser. En revanche, les anti-VEGF sont d’un appoint précieux dans le traitement des complications néovasculaires graves telles que la rubéose irienne ou le glaucome néovasculaire. Il est toutefois possible de traiter dans le même temps une RD et un œdème maculaire par anti-VEGF. Ces derniers auront un effet stabilisant de la RD permettant au laser d’être réalisé de façon adaptée car les séances sont souvent étalées sur plusieurs semaines.
Une étude prospective a montré qu’elles pouvaient prévenir ou faire régresser la néovascu-larisation prérétinienne ou prépapillaire. Cependant, ce traitement n’est que suspensif (en comparaison de la PPR) dans le traitement de la RD proliférante dont le traitement reste la PPR par laser. En revanche, les anti-VEGF sont d’un appoint précieux dans le traitement des complications néovasculaires graves telles que la rubéose irienne ou le glaucome néovasculaire. Il est toutefois possible de traiter dans le même temps une RD et un œdème maculaire par anti-VEGF. Ces derniers auront un effet stabilisant de la RD permettant au laser d’être réalisé de façon adaptée car les séances sont souvent étalées sur plusieurs semaines.
C Traitement de l’œdème maculaire
1 Injections intravitréennes d’anti-VEGF ou de corticoïdes
![]() Des injections d’anti-VEGF (ranibizumab, aflibercept) sont efficaces pour réduire l’œdème maculaire et maintenir ou améliorer l’acuité visuelle durant de nombreux mois. Ce traitement est indiqué en cas d’œdème atteignant le centre de la macula et associé à une baisse de l’acuité visuelle (fig. 20.16).
Des injections d’anti-VEGF (ranibizumab, aflibercept) sont efficaces pour réduire l’œdème maculaire et maintenir ou améliorer l’acuité visuelle durant de nombreux mois. Ce traitement est indiqué en cas d’œdème atteignant le centre de la macula et associé à une baisse de l’acuité visuelle (fig. 20.16).

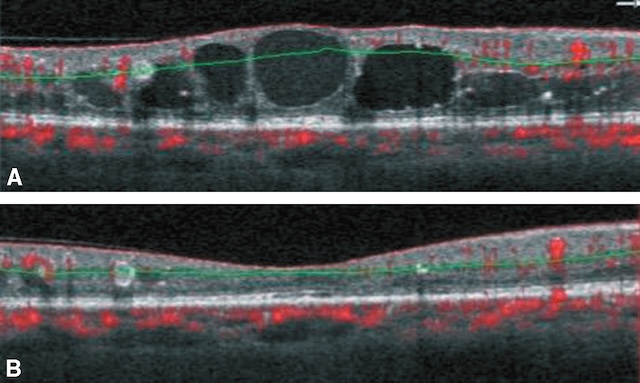
Noter la disparition des espaces microkystiques et le retour à un profil maculaire proche de la normale.
L’image A en tomographie en cohérence optique (OCT) révèle un œdème maculaire cystoïde typique, avec plusieurs cavités hypo-réflectives bien délimitées dans l’épaisseur de la rétine centrale, traduisant une accumulation de liquide intrarétinien. Les contours fovéolaires sont bombés, et l’épaississement rétinien est net. En B, un mois après l’injection intravitréenne d’un anti-VEGF, la rétine apparaît nettement asséchée. Les espaces kystiques ont disparu, la fovéa retrouve une configuration concave normale, et l’épaisseur rétinienne est considérablement réduite. Cette évolution témoigne d’une réponse favorable au traitement avec une résorption quasi complète du liquide.
Des injections de dexaméthasone retard ont également un effet favorable sur l’œdème macu-laire avec une durée de 3 à 4 mois, mais entraînent la formation d’une cataracte et un risque d’hypertonie oculaire dans 30 % des cas qui nécessiteront un traitement spécifique. Des injections intravitréennes d’acétonide de fluocinolone permettent de traiter des œdèmes maculaires chroniques avec une activité prolongée pendant 2 à 3 ans. Les complications d’hypertonie oculaire parfois sévères ou d’aggravation de la cataracte sont toutefois à prendre en compte dans le choix du traitement.
2 361Traitement par photocoagulation au laser de la maculopathie diabétique
La photocoagulation au laser pour œdème maculaire consiste à appliquer de façon localisée et non confluente des impacts de laser en regard des zones rétiniennes épaissies dans la région maculaire en épargnant les 1 500 |i centraux. ![]() Dans l’œdème maculaire diabétique, le laser est avant tout réservé au traitement des foyers d’œdème maculaire focal qui génèrent une accumulation d’exsudats lipidiques ou une accumulation de liquide dans le centre de la macula. Il est parfois intéressant de repérer des macroanévrismes diffusants responsables d’une composante focale. Le macroanévrisme, repéré par angiographie au vert d’indocyanine, est alors traité par des impacts directs de laser (fig. 20.17A,B). Contrairement à la photocoagulation pan-rétinienne, une seule séance (voire deux au maximum) est effectuée (fig. 20.18 et fig. 20.19).
Dans l’œdème maculaire diabétique, le laser est avant tout réservé au traitement des foyers d’œdème maculaire focal qui génèrent une accumulation d’exsudats lipidiques ou une accumulation de liquide dans le centre de la macula. Il est parfois intéressant de repérer des macroanévrismes diffusants responsables d’une composante focale. Le macroanévrisme, repéré par angiographie au vert d’indocyanine, est alors traité par des impacts directs de laser (fig. 20.17A,B). Contrairement à la photocoagulation pan-rétinienne, une seule séance (voire deux au maximum) est effectuée (fig. 20.18 et fig. 20.19).

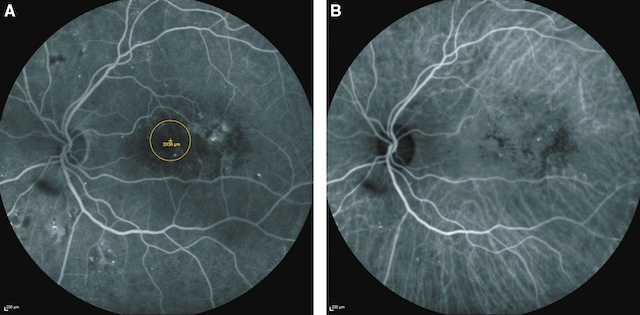
L’angiographie localise bien les zones de macroanévrismes diffusants. L’angiographie au vert d’indocyanine identifie les télangiectasies capillaires, accessibles au laser si elles sont situées en dehors des 1 000 |i centraux, même si des lasers couplés à l’angiographie permettent maintenant de sécuriser le geste.
Les deux images illustrent une angiographie fluorescéinique centrée sur la macula d’un œil gauche atteint d’un œdème maculaire diabétique. En A, on observe une hyperfluorescence diffuse dans la région maculaire, avec un cercle de mesure soulignant une zone de fuite centrale, traduisant une perméabilité vasculaire anormale. Des microanévrismes sont visibles en périphérie du foyer de fuite, formant un réseau irrégulier. En B, la diffusion de la fluorescéine s’étend, confirmant l’accumulation de liquide dans la rétine. Les contours maculaires sont moins définis, et l’imprégnation vasculaire est marquée, évoquant un œdème maculaire persistant ou évolutif.

Les impacts de laser sont blancs, et appliqués sur une zone limitée de la macula, en dehors du centre fovéolaire.
L’image montre un fond d’œil après une séance de photocoagulation focale dans le cadre d’un œdème maculaire diabétique. On distingue nettement une macula épaissie au centre, parsemée de multiples exsudats lipidiques jaunâtres organisés en couronne autour de la fovéa. Ces dépôts forment un aspect granuleux caractéristique, traduisant une fuite vasculaire chronique. On note également de légères marques blanchâtres circulaires, témoins récents de la photocoagulation au laser. Les vaisseaux rétiniens sont conservés, sans signe de néovascularisation active, mais le tableau reste celui d’un œdème persistant nécessitant une prise en charge ciblée.

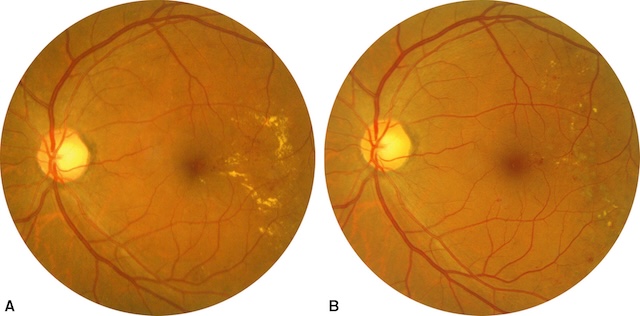
Les exsudats qui menaçaient le centre fovéolaire ont disparu et l’acuité visuelle est préservée.
L’image A montre un œdème maculaire diabétique avec une accumulation notable d’exsudats lipidiques jaunâtres en région temporale par rapport à la fovéa. Le disque optique est bien défini et les vaisseaux rétiniens apparaissent légèrement tortueux. À droite, sur l’image B prise après photocoagulation focale, la macula semble plus sèche, les dépôts lipidiques sont réduits et mieux organisés. On distingue quelques impacts de laser discrets, preuve d’un traitement ciblé sur les zones de fuite. L’ensemble traduit une amélioration morphologique après intervention.
 Compléments en ligne
Compléments en ligne
Quelles sont les propositions exactes concernant cette figure ?
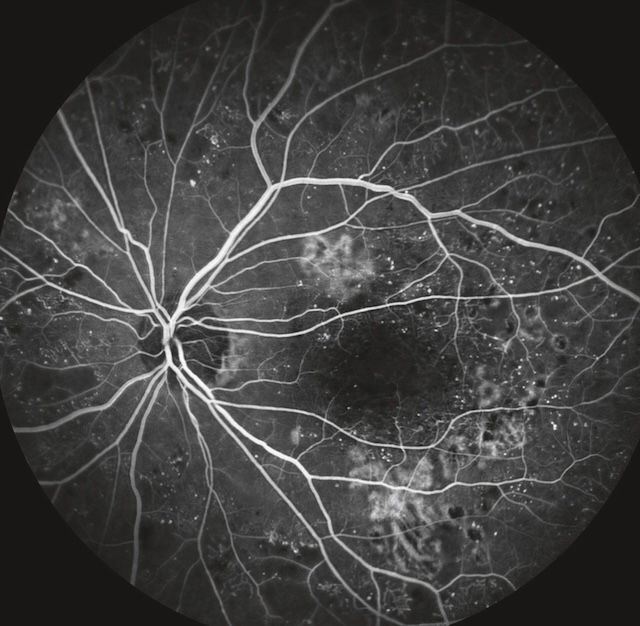
Cette angiographie à la fluorescéine met en évidence un œdème maculaire associé à une rétinopathie diabétique. On observe des fuites diffuses de fluorescéine centrées sur la macula, formant une zone d’hyperfluorescence irrégulière. Des microanévrismes et exsudats durs sont visibles tout autour, notamment en temporal inférieur, accompagnés de zones capillaires non perfusées. Les vaisseaux rétiniens apparaissent dilatés et tortueux, témoins d’une atteinte microvasculaire avancée. L’aspect global suggère une activité vasculaire marquée avec altération de la barrière hématorétinienne.
Monsieur M., âge de 55 ans, diabétique de type 2 depuis 10 ans, vient vous consulter. La rétinophotographie couleur montre l’aspect suivant.
Quelle est la proposition exacte ?
Concernant l’examen présenté, quelles sont les propositions exactes ?
Quelle est la proposition exacte concernant cet examen ?
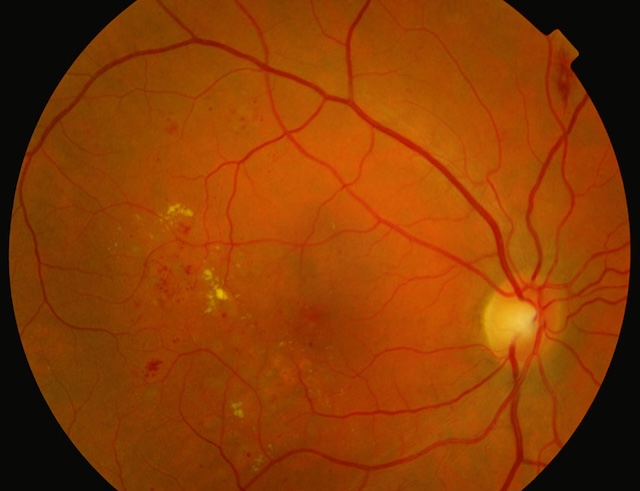
Cette rétinophotographie couleur montre une maculopathie diabétique avec présence d’exsudats lipidiques jaunes bien visibles, disposés en anneau autour de la région maculaire. Des hémorragies punctiformes et des microanévrismes sont également disséminés dans la rétine, principalement en temporal inférieur de la fovéa. Les vaisseaux rétiniens principaux apparaissent légèrement tortueux, mais bien individualisés. La papille optique est de coloration normale, bien délimitée, sans signe d’œdème papillaire. L’ensemble reflète une rétinopathie diabétique non proliférante avec atteinte maculaire focale.
Quelles sont les propositions exactes concernant l’examen fait à un patient ?
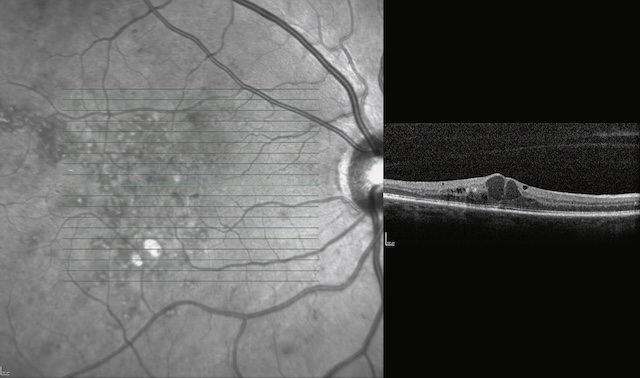
Cette image couplant une rétinophotographie en mode infrarouge et une coupe OCT montre clairement un œdème maculaire cystoïde. À droite, la coupe OCT révèle plusieurs cavités hypo-réflectives intra-rétiniennes bien circonscrites, situées au sein de la couche nucléaire interne et externe, caractéristiques d’une accumulation de liquide interstitiel. L’architecture fovéale est nettement désorganisée, avec un soulèvement du contour central. À gauche, la trame de balayage montre une densité vasculaire irrégulière et une hyperréflectivité maculaire témoignant d’un œdème. Aucun signe de membrane épirétinienne n’est visible sur ce plan.
Sur le cliché suivant, identifier les lésions désignées par le cercle.
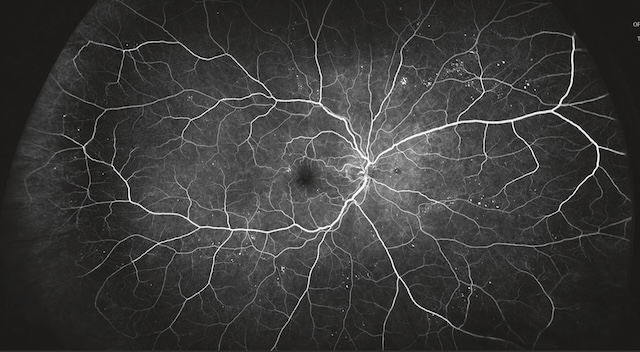
Cette angiographie fluorescéinique montre une rétine avec un réseau vasculaire bien contrasté. On observe une hyperfluorescence diffuse des capillaires périfovéolaires, traduisant une fuite vasculaire active. Plusieurs microanévrismes sont visibles, dispersés autour de la région maculaire et le long des arcades vasculaires, sous forme de petits points hyperfluorescents. Des exsudats durs, à l’aspect granuleux, sont présents dans les quadrants temporaux, marquant des dépôts lipidiques liés à des fuites chroniques. L’architecture veineuse reste bien dessinée sans signes de néovaisseaux apparents ni d’occlusion capillaire périphérique.
Quel est l’acte laser pratiqué chez cette patiente porteuse d’une rétinopathie diabétique proliférante ?
Monsieur T., diabétique de type 1 depuis 15 ans, en rupture de suivi diabétique, vient vous voir pour une baisse de vision de son œil droit. Le fond d’œil montre l’aspect suivant. Quel est le niveau de sa rétinopathie diabétique ?
Quelles sont les propositions exactes concernant cette image du fond d’œil d’une patiente de 65 ans avec un diabète de type 2 avec une hémoglobine glyquée à 8 % et une pression artérielle à 15/10 mmHg ?
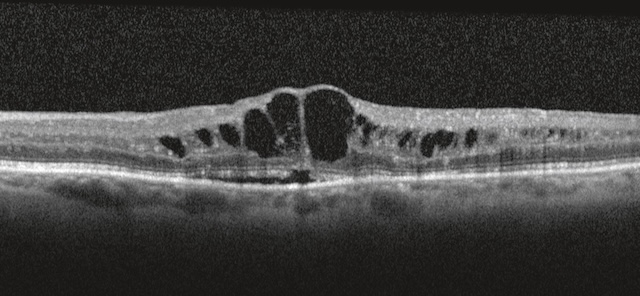
Cette image en coupe transversale obtenue par tomographie par cohérence optique (OCT) révèle un œdème maculaire cystoïde marqué. De multiples cavités hyporéflectives bien circonscrites, à parois nettes, sont visibles dans les couches internes de la rétine, avec une prédominance centrale. Ces logettes intrarétiniennes traduisent une rétention liquidienne importante. La fovéa est élargie et déformée, avec une perte de son architecture normale. La ligne de l’épithélium pigmentaire reste toutefois relativement continue. Aucun décollement de rétine neurosensorielle n’est noté ici, mais la densité globale des couches profondes semble altérée.
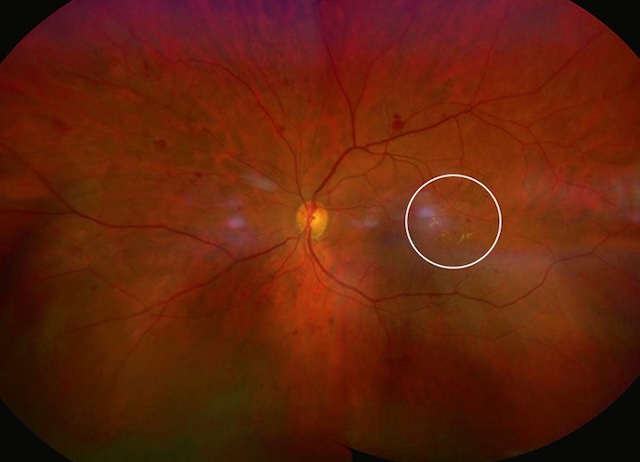
Sur cette rétinophotographie couleur grand champ, on observe une lésion circonscrite dans le quadrant temporal inférieur, soulignée par un cercle blanc. Elle correspond à une zone d’exsudats lipidiques jaunes brillants, associés à des microanévrismes et des hémorragies punctiformes, traduisant une rétinopathie diabétique localisée. Le fond d’œil montre une vascularisation relativement bien préservée en dehors de cette région, avec une papille optique bien délimitée et un réseau veineux légèrement tortueux. La macula semble épargnée par l’épanchement direct, mais l’extension périphérique des lésions peut annoncer une évolution vers une forme plus avancée.
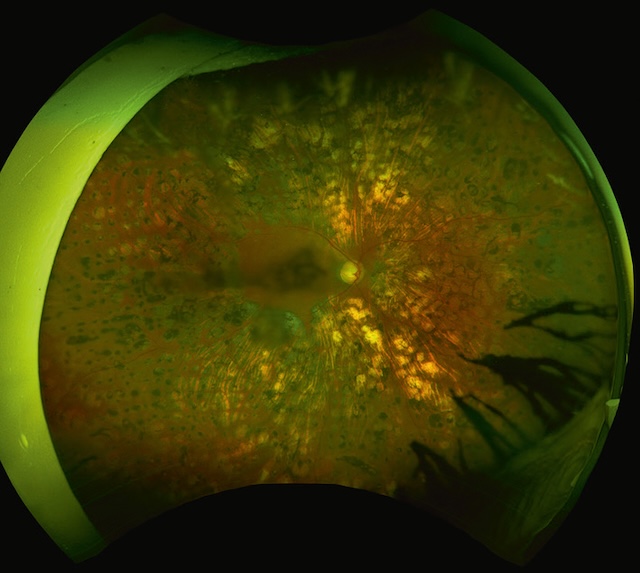
Cette image en ultra grand champ montre une rétine profondément altérée par une rétinopathie diabétique proliférante traitée. On distingue des centaines de cicatrices blanchâtres réparties de façon diffuse, typiques d’une photocoagulation panrétinienne étendue. Le fond rétinien est irrégulier, avec des zones d’hyper- et d’hypopigmentation et des remaniements fibrovasculaires marqués. La région papillaire est visible au centre, mais le contraste est réduit par la densité des lésions. Dans la périphérie temporale inférieure, une traction rétinienne est suggérée par des ombres arboriformes épaisses, possiblement liées à une fibrose prérétinienne.
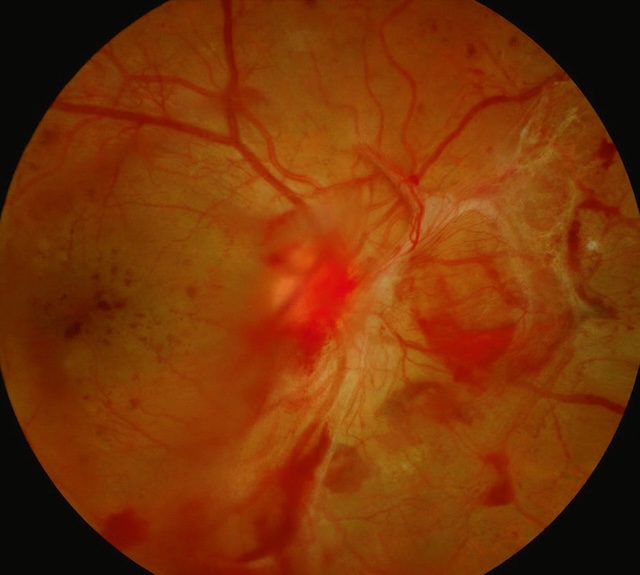
Sur cette rétinophotographie, on observe une scène marquée par une rétinopathie diabétique proliférante avec hémorragie prérétinienne active. De larges nappes rouges, d’aspect dense, trahissent des saignements situés juste en avant de la rétine, dans le plan sous-hyalinien. Des zones blanchâtres fibreuses, notamment au-dessus et autour des vaisseaux, évoquent une traction vitréo-rétinienne avec membranes fibrovasculaires. L’organisation anarchique des vaisseaux et l’aspect flou de certaines structures renforcent la suspicion d’une traction significative, potentiellement évolutive vers un décollement tractionnel.
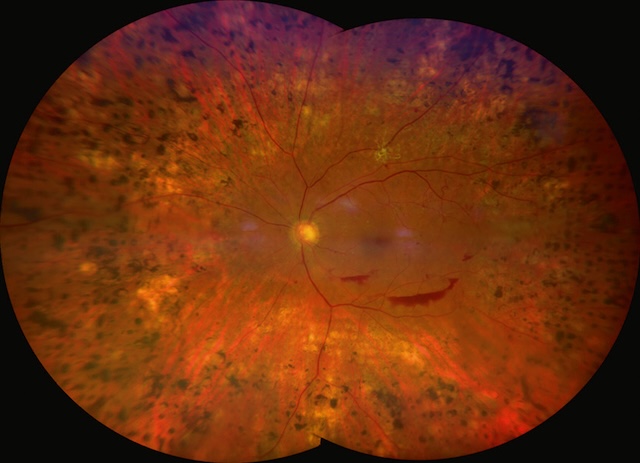
L’image montre un fond d’œil présentant des signes avancés de rétinopathie diabétique proliférante. Le champ rétinien est constellé de cicatrices pigmentées issues d’une photocoagulation panrétinienne extensive. Au centre, une hémorragie prérétinienne bien délimitée en forme de « D » inversé se distingue nettement sous l’axe maculaire inférieur. Les néovaisseaux rétiniens sont discrets, masqués en partie par l’hémorragie et la fibrose. Le nerf optique reste clair, mais entouré de quelques zones exsudatives et de discrets remaniements vasculaires. L’ensemble évoque un stade sévère et instable, nécessitant un suivi rapproché.
- A II s’agit d’une rétinophotographie couleur
- B Cette patiente présente une rétinopathie diabétique proliférante
- C Elle a bénéficié d’une panphotocoagulation rétinienne
- D Elle présente une hémorragie prérétinienne
- E Son équilibre glycémique et de pression artérielle est bien adapté aux cibles souhaitables
 Compléments en ligne
Compléments en ligne
Des compléments numériques sont associés à ce chapitre. Ils sont indiqués dans le texte par un picto. Pour voir ces compléments, connectez-vous sur http://www.em-consulte.com/ e-complements/478662 et suivez les instructions.
