CHAPITRE 1: Sémiologie oculaire
Pr A. Sauer – CHU de Strasbourg and , Pr J.-L. Bourges, OphtalmoPôle de Paris, Hôpital Cochin, AP-HP, Paris
Situations cliniques de départ
 42 – Hypertension artérielle : description sémiologique des anomalies au fond d’oeil.
42 – Hypertension artérielle : description sémiologique des anomalies au fond d’oeil.
 138 – Anomalie de la vision : description sémiologique.
138 – Anomalie de la vision : description sémiologique.
 139 – Anomalies palpébrales : description sémiologique.
139 – Anomalies palpébrales : description sémiologique.
 141 – Sensation de brûlure oculaire : description sémiologique.
141 – Sensation de brûlure oculaire : description sémiologique.
 143 – Diplopie : description sémiologique.
143 – Diplopie : description sémiologique.
 152 – œil rouge et/ou douloureux : description sémiologique.
152 – œil rouge et/ou douloureux : description sémiologique.
 178 – Demande/prescription raisonnée et choix d’un examen diagnostique : description des différentes phases de l’examen ophtalmologique et des examens complémentaires permettant de compléter une prise en charge.
178 – Demande/prescription raisonnée et choix d’un examen diagnostique : description des différentes phases de l’examen ophtalmologique et des examens complémentaires permettant de compléter une prise en charge.
 232 – Demande d’explication d’un patient sur le déroulement, les risques et les bénéfices attendus d’un examen d’imagerie : spécificités de l’angiographie rétinienne.
232 – Demande d’explication d’un patient sur le déroulement, les risques et les bénéfices attendus d’un examen d’imagerie : spécificités de l’angiographie rétinienne.
Hiérarchisation des connaissances
| Rang | Rubrique | Intitulé et descriptif |
|
|
Physiopathologie | Connaître les bases physiologiques, les modalités et les conditions de la mesure de l’acuité visuelle Comprendre les bases de la réfraction optique |
|
|
Définition | Savoir définir l’œil emmétrope Savoir définir la presbytie, ses conséquences, son mode de correction optique |
|
|
Diagnostic positif | Connaître les modalités de dépistage d’un strabisme et d’un risque d’amblyopie chez l’enfant |
|
|
Diagnostic positif | Savoir déterminer si un trouble visuel est mono- ou binoculaire Savoir interpréter un réflexe photomoteur |
|
|
Diagnostic positif | Savoir déterminer si une diplopie est mono- ou binoculaire |
|
|
Diagnostic positif | Connaître les éléments de l’interrogatoire et de l’examen clinique |
|
|
Diagnostic positif | Connaître la définition des tests cliniques ophtalmologiques |
|
|
Examens complémentaires | Connaître les principaux examens complémentaires en ophtalmologie et leurs indications |
I 4Rappel anatomique
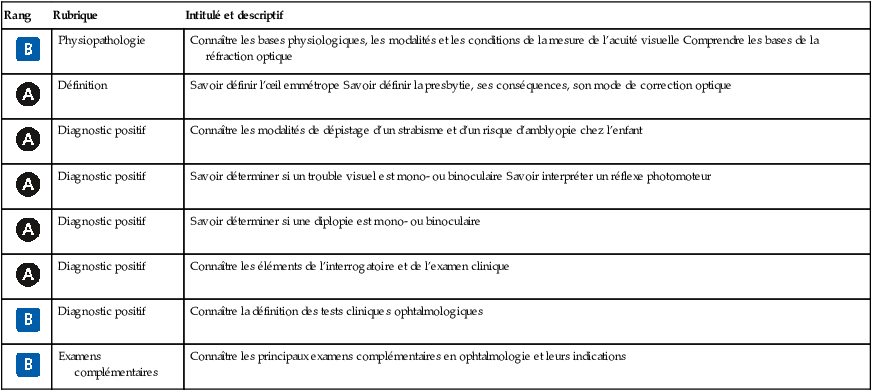
![]() On définit classiquement un contenant formé de trois « enveloppes » ou « membranes » et un contenu (fig. 1.1).
On définit classiquement un contenant formé de trois « enveloppes » ou « membranes » et un contenu (fig. 1.1).

Ce schéma représente une coupe anatomique très détaillée de l’œil humain, dessinée avec précision pour montrer l’agencement finement coordonné des structures visuelles. On y distingue la cornée à l’avant, qui laisse passer la lumière, suivie par la chambre antérieure bordée de l’iris et de l’angle irido-cornéen, où se situe le canal de Schlemm, petit mais essentiel pour le drainage du liquide intraoculaire. Juste derrière, le cristallin suspendu par les fibres de la zonule aux procès ciliaires ajuste sa courbure pour permettre la mise au point. La lumière continue son trajet jusqu’à la rétine, en passant par un milieu transparent et parfaitement organisé. On y observe la choroïde, riche en vaisseaux, qui nourrit la rétine, ainsi que la sclère qui forme la coque protectrice de l’œil. L’ora serrata marque la fin de la partie photosensible de la rétine. Enfin, la papille optique et le nerf optique signalent le point de départ du message visuel vers le cerveau. Ce type d’image, simple mais rigoureusement conçue, permet de comprendre d’un seul regard le fonctionnement de notre vision.
1 Contenant
a Membrane externe ou coque cornéosclérale
La membrane externe est constituée en arrière par une coque fibreuse de soutien, la sclère, prolongée en avant par la cornée transparente; sur la sclère viennent s’insérer les muscles oculomoteurs; la jonction entre sclère et cornée est dénommée limbe sclérocornéen. La partie antérieure de la sclère est recouverte jusqu’au limbe par la conjonctive. La sclère présente à sa partie postérieure un orifice dans lequel s’insère l’origine du nerf optique, dénommée tête du nerf optique ou papille.
b Membrane intermédiaire ou uvée
La membrane intermédiaire est constituée d’arrière en avant par :
- • la choroïde, tissu essentiellement vasculaire responsable de la nutrition de l’épithélium pig-mentaire et des couches externes de la rétine neurosensorielle;
- • les corps ciliaires dont la portion antérieure est constituée par les procès ciliaires responsables de la sécrétion d’humeur aqueuse et sur lesquels est insérée la zonule, ligament 5suspenseur du cristallin, et par le muscle ciliaire, dont la contraction permet l’accommodation par les changements de forme du cristallin transmis par la zonule;
- • l’iris, diaphragme circulaire perforé en son centre par la pupille, dont l’orifice est de petit diamètre à la lumière vive (myosis) et de grand diamètre à l’obscurité (mydriase). Le jeu pupillaire est sous la dépendance de deux muscles : le sphincter de la pupille et le dilatateur de l’iris.
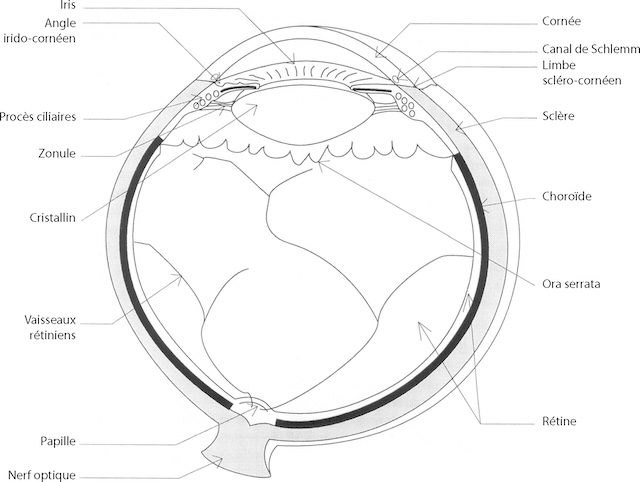
c Membrane interne ou rétine (fig. 1.2)
La membrane interne s’étend à partir du nerf optique en arrière et tapisse toute la face interne de la choroïde pour se terminer en avant en formant une ligne festonnée, l’ora serrata; la rétine est constituée de deux tissus : la rétine neurosensorielle et l’épithélium pigmentaire :

Ce dessin illustre avec rigueur l’architecture microscopique de la rétine, vue en coupe histologique. Chaque étage de ce tissu hautement spécialisé est représenté dans un alignement vertical soigné, depuis l’épithélium pigmentaire au bas du schéma jusqu’aux fibres optiques en haut. On y distingue les deux portions des photorécepteurs - les articles internes et externes - chargés de capter la lumière. Ces cellules transmettent l'information aux cellules bipolaires, elles-mêmes en contact avec les cellules ganglionnaires, qui relaient finalement les signaux visuels vers les fibres du nerf optique. L’ensemble forme un réseau stratifié où chaque niveau a un rôle précis dans le traitement de l’image, rendant possible la perception visuelle. L’image, bien que schématique, met en évidence la transmission verticale de l’information, et souligne la parfaite coordination entre ces couches cellulaires.
- • la rétine neurosensorielle est composée des premiers neurones de la voie optique comprenant les photorécepteurs (cônes et bâtonnets), les cellules bipolaires et les cellules ganglionnaires dont les axones constituent les fibres optiques qui se réunissent au niveau de la papille pour former le nerf optique. Avec le nerf optique cheminent les vaisseaux centraux de la rétine (artère centrale de la rétine et veine centrale de la rétine) qui se divisent en plusieurs pédicules juste après leur émergence au niveau de la papille; les vaisseaux rétiniens sont responsables de la nutrition des couches internes de la rétine;
- • l‘épithélium pigmentaire constitue une couche cellulaire monostratifiée apposée contre la face externe de la rétine neurosensorielle.
La fonction principale de la rétine, la phototransduction, est assurée par les photorécepteurs en synergie avec l’épithélium pigmentaire. Les articles externes des photorécepteurs entourés par les villosités de l’épithélium pigmentaire renferment des disques contenant le pigment visuel (rhodopsine, composée d’une protéine, l’opsine, et de vitamine A ou rétinal), qui est « blanchi » par la lumière (rupture entre l’opsine et le rétinal). Il s’ensuit une chaîne de réactions aboutissant à la libération d’un messager qui modifie la polarisation de la membrane plasmatique; ainsi naît l’influx nerveux qui va cheminer le long des voies optiques jusqu’au cortex occipital.
La rhodopsine est resynthétisée au cours du « cycle visuel ». L’épithélium pigmentaire assure quant à lui le renouvellement des disques par un mécanisme de phagocytose.
2 6Contenu
Le contenu est constitué de milieux transparents permettant le passage des rayons lumineux jusqu’à la rétine.
a Humeur aqueuse
Liquide transparent et fluide, l’humeur aqueuse remplit la chambre antérieure, délimitée par la cornée en avant et l’iris en arrière. Sécrétée en permanence par les procès ciliaires, l’humeur aqueuse est évacuée au niveau de l’angle iridocornéen à travers le trabéculum dans le canal de Schlemm qui rejoint la circulation générale; une gêne à son évacuation provoque une élévation de la pression intraoculaire (valeur normale : inférieure ou égale à 21 mmHg).
b Cristallin
C’est une lentille biconvexe, convergente, amarrée aux procès ciliaires par son ligament sus-penseur, la zonule. Elle est capable de se déformer par tension ou relâchement de la zonule sous l’effet de la contraction du muscle ciliaire, et de modifier ainsi son pouvoir de convergence. Cela permet le passage de la vision de loin à la vision de près qui constitue l’accommodation; la perte du pouvoir d’accommodation du cristallin avec l’âge est responsable de la presbytie qui nécessite le port de verres correcteurs convergents pour la lecture.
c Corps vitré
Il s’agit d’un gel transparent, entouré d’une fine membrane, la hyaloïde, qui remplit les 4/5e de la cavité oculaire et tapisse par sa face postérieure (hyaloïde postérieure) la face interne de la rétine.
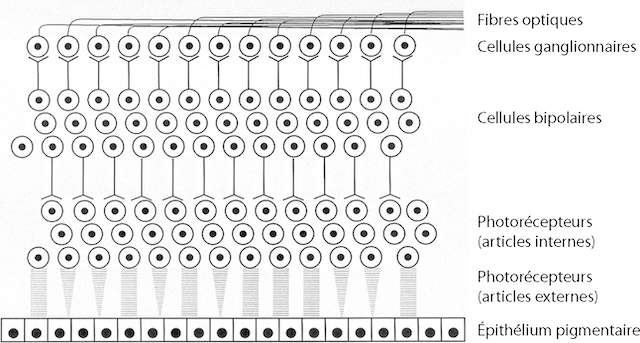
Le globe oculaire est classiquement subdivisé en deux régions comprenant les structures précédemment décrites (fig. 1.3) :

Ce schéma en coupe transversale du globe oculaire met en évidence la distinction entre segment antérieur et segment postérieur. La ligne verticale noire sert de repère clair entre ces deux portions fonctionnelles de l’œil. À gauche, le segment antérieur comprend la cornée, la chambre antérieure et le cristallin, visibles par des formes concentriques dégradées. À droite, le segment postérieur occupe une plus grande surface, représenté par une zone sombre homogène cernée d’une paroi claire, correspondant à l’ensemble cavitaire rempli par le corps vitré. La représentation, en niveaux de gris, souligne l’organisation interne sans surcharge graphique, permettant de visualiser les rapports de volume entre les deux segments, essentiels dans l’analyse fonctionnelle de l’œil.
B 7Voies optiques
Permettant la transmission des impressions lumineuses rétiniennes aux centres corticaux de la vision, les voies optiques (fig. 1.4) comprennent le nerf optique, qui traverse l’orbite et pénètre dans le crâne par les trous optiques; son extrémité antérieure (tête du nerf optique) est visible à l’examen du fond d’œil (papille).

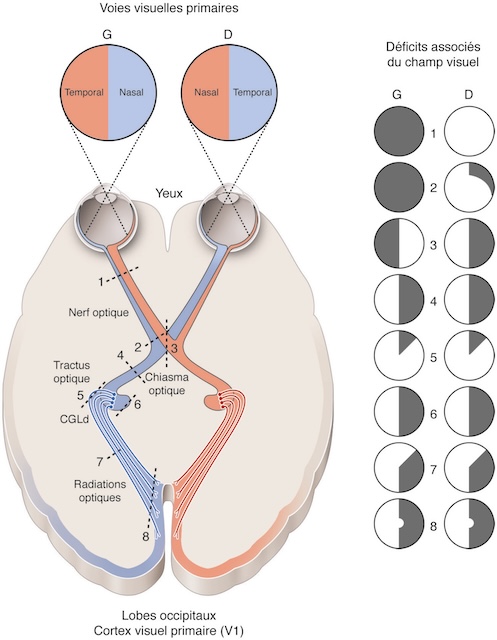
CGLd : corps genouillé latéral dorsal.
Illustration de Cyrille Martinet.
Ce schéma illustre de façon claire et structurée l’organisation des voies visuelles primaires, depuis les yeux jusqu’aux lobes occipitaux, tout en mettant en parallèle les conséquences visuelles de lésions sur différentes portions de cette voie. Chaque œil capte à la fois des informations du champ visuel nasal et temporal, qui sont ensuite transmises via les nerfs optiques. Au niveau du chiasma optique, une partie des fibres croisent la ligne médiane, permettant ainsi une projection des champs visuels gauches et droits vers les hémisphères cérébraux opposés. Le trajet se poursuit à travers les tractus optiques, les corps géniculés latéraux (CGLd), puis les radiations optiques qui convergent vers le cortex visuel primaire. La colonne de droite présente les types de déficits visuels selon la localisation de la lésion, numérotée de 1 à 8, et illustrée par des zones grises et blanches sur des représentations circulaires des champs visuels gauches (G) et droits (D). Ces représentations cliniques permettent d’associer chaque atteinte anatomique à une perte précise de la perception visuelle.
Au-dessus de la selle turcique, les deux nerfs optiques se réunissent pour former le chiasma où se fait un croisement partiel des fibres optiques (hémidécussation), intéressant uniquement les fibres en provenance des hémirétines nasales; les fibres issues de la partie temporale de la rétine gagnent quant à elles la voie optique homolatérale.
8Des angles postérieurs du chiasma partent les bandelettes optiques qui contiennent les fibres provenant des deux hémirétines regardant dans la même direction. Elles contournent les pédoncules cérébraux pour se terminer dans les corps genouillés externes, qui font saillie sur la face latérale du pédoncule cérébral.
De là partent les radiations optiques : constituées par le troisième neurone des voies optiques, elles forment une lame de substance blanche intracérébrale moulée sur la face externe du ventricule latéral et qui gagne le cortex visuel situé sur la face interne du lobe occipital. Elles se divisent en deux faisceaux : supérieur (qui gagne la lèvre supérieure de la scissure calcarine) et inférieur (qui gagne la lèvre inférieure de la scissure calcarine).
Le réflexe photomoteur (RPM) est la constriction pupillaire (myosis) survenant à l’éclairement d’un œil; il fonctionne de façon analogue au diaphragme automatique d’un appareil photo ou d’une caméra :
- • la voie afférente du RPM chemine avec les voies optiques : elle débute au niveau des photorécepteurs rétiniens stimulés par la lumière; les fibres pupillomotrices cheminent le long des nerfs optiques jusqu’au chiasma où elles subissent une hémidécussation, puis le long des bandelettes optiques jusqu’aux corps genouillés externes; elles ne suivent pas les radiations optiques mais gagnent les deux noyaux du III;
- • la voie efférente parasympathique du RPM emprunte le trajet du III et se termine au niveau du sphincter de l’iris;
- • chez un sujet normal, à l’éclairement d’un œil, on observe un myosis réflexe du même côté : c’est le RPM direct; mais, du fait de l’hémidécussation des fibres pupillomotrices au niveau du chiasma, on observe également, par la voie du III controlatéral, un myosis de l’œil opposé : c’est le RPM consensuel;
- • lors d’une mydriase d’origine sensorielle, secondaire à une baisse de vision sévère (par exemple occlusion de l’artère centrale de la rétine, neuropathie optique) :
- – à l’éclairement de l’œil atteint, la voie afférente du RPM étant « supprimée » du fait de la baisse de vision, le RPM direct est aboli, mais également le RPM consensuel;
- – à l’éclairement de l’autre œil, à l’inverse, la voie afférente étant normale sur cet œil et la voie efférente étant normale sur les deux yeux, le RPM est conservé aux deux yeux.
- • lors d’une mydriase paralytique (mydriase par paralysie du III) :
- – à l’éclairement de l’œil atteint, la voie afférente du RPM étant conservée, on observe une abolition du RPM direct (liée à la paralysie du sphincter irien) mais le RPM consensuel est conservé;
- – à l’inverse, à l’éclairement de l’autre œil, le RPM direct est conservé, mais le RPM consensuel (RPM de l’œil atteint) est aboli.
- • la voie efférente sympathique, contrairement à la voie parasympathique, assure la dilatation pupillaire (mydriase); elle naît dans l’hypothalamus, puis suit un trajet complexe passant notamment par le ganglion cervical supérieur et la carotide primitive; elle gagne ensuite l’orbite et le muscle dilatateur de l’iris; un rameau se détache dans l’orbite et gagne un muscle intrapalpébral, le « muscle rétracteur de la paupière supérieure » ou muscle de Müller (à différencier du muscle releveur de la paupière supérieure, sous la dépendance du III).
C 9Annexes oculaires
L’œil peut être mobilisé dans différentes directions grâce à six muscles striés (quatre muscles droits et deux muscles obliques), sous l’influence de l’innervation des nerfs oculomoteurs :
- • le III ou nerf oculomoteur innerve les muscles droit supérieur, droit médial, droit inférieur et oblique inférieur; il assure de plus le réflexe photomoteur et l’accommodation ainsi que l’innervation du muscle releveur de la paupière supérieure;
- • le IV ou nerf trochléaire innerve le muscle oblique supérieur;
- • le VI ou nerf abducens innerve le muscle droit externe.
De plus, des centres supranucléaires, situés en amont des noyaux des nerfs oculomoteurs, permettent des mouvements synchrones des deux globes oculaires (centre de la latéralité, de l’élévation, etc.).
Ainsi, par exemple, dans le regard à droite, le centre de la latéralité assure par l’intermédiaire des noyaux du III et du VI la mise en jeu synchrone et symétrique du muscle droit interne de l’œil gauche et du muscle droit externe de l’œil droit.
2 Appareil de protection du globe oculaire
- • les paupières (fig. 1.5), formées par une charpente fibreuse rigide (le tarse) et un muscle (l’orbiculaire), qui permet l’occlusion palpébrale sous la dépendance du nerf facial; le clignement physiologique permet un étalement du film lacrymal à la surface de la cornée;

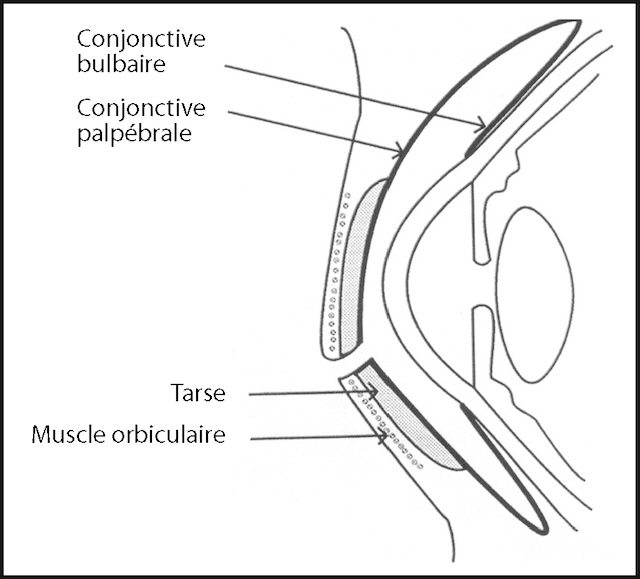
Fig. 1.5 Paupières et conjonctive. Ce schéma met en lumière avec précision l’anatomie fine des paupières et de la conjonctive, dans une vue en coupe qui révèle toute la complexité de cette interface protectrice de l’œil. On y distingue la conjonctive bulbaire, fine membrane qui recouvre la surface visible du globe oculaire, et la conjonctive palpébrale, accolée à l’intérieur des paupières. Ces deux zones se rejoignent pour former un espace continu essentiel à la mobilité et à la lubrification de l’œil. Le tarse, structure rigide nichée dans la paupière, lui confère sa forme et sa tenue, tandis que le muscle orbiculaire, situé juste sous la peau, intervient activement dans le clignement. Ce schéma, loin d’être une simple illustration, permet de comprendre comment chaque élément contribue à la protection oculaire au quotidien, rendant visibles les structures souvent oubliées mais pourtant fondamentales du regard.
- • la conjonctive (voir fig. 1.5) qui recouvre la face interne des paupières (conjonctive palpé-brale ou tarsale) et la portion antérieure du globe oculaire (conjonctive bulbaire) jusqu’au limbe sclérocornéen;
- • le film lacrymal, qui assure l’humidification permanente de la cornée; il est sécrété par la glande lacrymale principale, située de chaque côté à la partie supéro-externe de l’orbite, et par des glandes lacrymales accessoires situées dans les paupières et la conjonctive; il est évacué par les voies lacrymales qui communiquent avec les fosses nasales par le canal lacry-monasal (fig. 1.6). Une diminution de sécrétion lacrymale par une atteinte pathologique des glandes lacrymales peut être responsable d’un syndrome sec, mis en évidence par le test de Schirmer et le break-up time (voir chapitre 6); une obstruction des voies lacrymales peut entraîner l’apparition d’un larmoiement.

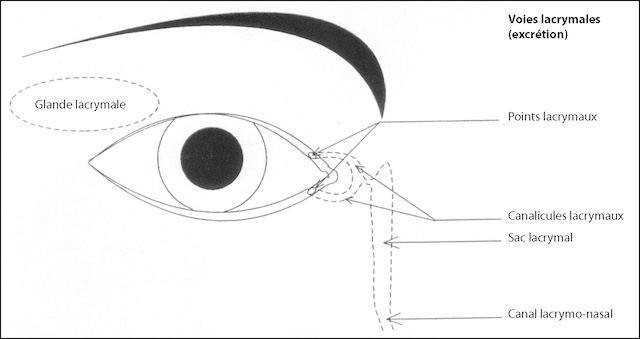
Fig. 1.6 Glande et voies lacrymales. Ce dessin montre avec clarté comment les larmes sont produites et évacuées. Tout commence au niveau de la glande lacrymale, située vers le coin supérieur externe de l’œil. Elle fabrique les larmes qui viennent ensuite se répandre à la surface de l’œil. Ces larmes excédentaires sont récupérées par de petits orifices discrets appelés points lacrymaux, visibles sur les bords des paupières. Elles passent ensuite dans deux petits conduits, les canalicules, qui convergent vers un réservoir : le sac lacrymal. De là, les larmes poursuivent leur trajet par le canal lacrymo-nasal, qui les fait s’écouler dans la cavité nasale. Ce mécanisme discret mais essentiel permet à l’œil de rester propre et bien hydraté, sans que l’on y pense.
II 10Examen du malade en ophtalmologie
L’interrogatoire a pour but essentiel de préciser le trouble visuel :
- • baisse d’acuité visuelle : elle peut intéresser la vision de près et/ou la vision de loin :
- – certaines affections entraînent préférentiellement une baisse d’acuité visuelle de loin (par exemple cataracte sénile),
- – d’autres génèrent à la fois une baisse d’acuité visuelle de loin et de près (par exemple les principales affections de la macula),
- – une gêne en vision de près isolée, non corrigée, est due le plus souvent à une presbytie,
- – la baisse d’acuité visuelle peut être permanente ou transitoire; on parle alors d’amau-rose transitoire (voir chapitre 8);
- • myodésopsies (sensation de « mouches volantes » ou de « corps flottants »), faisant rechercher une possible hémorragie intravitréenne et photopsies (sensation d’éclairs lumineux) traduisant une stimulation de la neurorétine. Ils sont le sont le plus souvent des signes bénins (dans le cadre d’un décollement postérieur du vitré);
- • phosphènes, parfois révélateurs d’une déchirure rétinienne, associés ou non à un décollement de la rétine;
- • métamorphopsies : il s’agit d’une déformation des lignes droites qui apparaissent ondulées et signent une atteinte maculaire;
- • héméralopie : elle correspond à une gêne en vision crépusculaire ou lors du passage d’un milieu bien éclairé à l’obscurité, principal signe de la rétinopathie pigmentaire;
- • anomalie du champ visuel ou scotome. Il peut s’agir :
- – d’un scotome central ou cœcocentral : tache centrale sombre (scotome central relatif) ou complètement noire (scotome central absolu), associée à une baisse d’acuité visuelle; un scotome central et/ou des métamorphopsies sont dépistés à l’aide d’une grille d’Amsler (fig. 1.7),

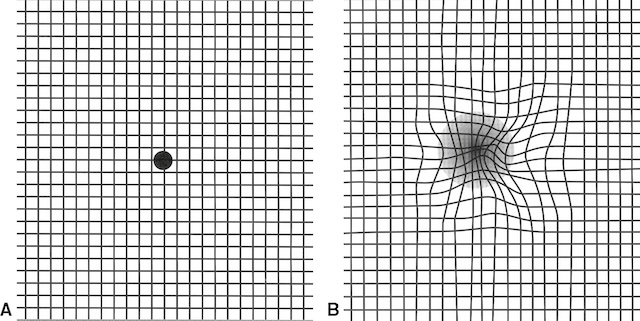
Fig. 1.7 Grille d’Amsler.
A. Sujet normal. B. Scotome central et métamorphopsies.Cette représentation issue d’un test Amsler permet d’évaluer la qualité de la vision centrale. Dans la première grille (A), toutes les lignes sont droites, uniformément espacées, et convergent vers un point noir central fixe, ce qui suggère une perception visuelle normale sans anomalies du champ central. En revanche, la seconde grille (B) présente des lignes qui paraissent ondulées, déformées autour du centre, accompagnées d’une zone floue ou assombrie, caractéristique d’un trouble affectant la zone maculaire. Ce type de déformation est typiquement observé chez les personnes présentant une dégénérescence maculaire ou d’autres atteintes de la rétine centrale. L’examen visuel de ces deux grilles permet de détecter précocement des altérations de la vision fine.
- – 11d’une amputation du champ visuel périphérique qui peut être soit monoculaire, par atteinte rétinienne ou du nerf optique, soit binoculaire, par atteinte neurologique rétro-bulbaire ou centrale.
- – d’un scotome central ou cœcocentral : tache centrale sombre (scotome central relatif) ou complètement noire (scotome central absolu), associée à une baisse d’acuité visuelle; un scotome central et/ou des métamorphopsies sont dépistés à l’aide d’une grille d’Amsler (fig. 1.7),
Un relevé précis du champ visuel est obtenu par la périmétrie (voir plus loin).
Le mode d’installation des signes doit impérativement être précisé :
- • progressif, il évoque une affection d’évolution lente (par exemple cataracte, troubles de la réfraction, etc.);
- • brutal, il évoque une atteinte nécessitant une prise en charge urgente (par exemple méta-morphopsies d’apparition brutale évoquant une forme compliquée de dégénérescence maculaire liée à l’âge [DMLA], baisse d’acuité visuelle brutale par occlusion artérielle rétinienne ou neuropathie optique aiguë).
L’interrogatoire veille à caractériser le type de douleurs :
L’existence d’une diplopie (vision double) doit être recherchée; il peut s’agir d’une diplopie monoculaire ou binoculaire :
12L’interrogatoire précise l’évolution des signes :
Enfin, l’interrogatoire doit recenser les éventuels antécédents oculaires :
B Mesure de l’acuité visuelle
Voir chapitre 2.
 La mesure de l’acuité visuelle, qui est couplée à une étude de la réfraction, est réalisée séparément pour chaque œil et à deux distances d’observation (fig. 1.8, e-fig. 1.9 et e-fig. 1.10) :
La mesure de l’acuité visuelle, qui est couplée à une étude de la réfraction, est réalisée séparément pour chaque œil et à deux distances d’observation (fig. 1.8, e-fig. 1.9 et e-fig. 1.10) :


Cette série de trois vues montre les conditions optimales à respecter lors d’un test de la vue. Sur la première photo à gauche, la tête du patient est bien droite, alignée avec le dispositif de mesure. Le regard est centré, sans inclinaison ni rotation. Au centre, la scène illustre la lecture à distance. Le patient regarde un tableau placé à cinq mètres, dans l’axe de l’appareil, le dos droit et la tête stable. Enfin, sur la photo de droite, on observe la position adoptée pour la lecture de près : le patient tient une carte à environ 30 centimètres de ses yeux, toujours avec une posture bien équilibrée. Chaque étape respecte une mise en place rigoureuse pour garantir la précision du test visuel.
- • de loin, où l’échelle de lecture est placée à 5 mètres, l’acuité étant chiffrée en 10es : l’échelle la plus utilisée est celle de Monoyer (fig. 1.11) utilisant des lettres capitales de taille décroissante (lettres optotypes) pour chiffrer l’acuité visuelle de 1 à 10/10es;


Fig. 1.11 Échelle d’acuité visuelle de loin de type Monoyer. On a ici un tableau de lecture utilisé pour tester la vue. Les lettres sont disposées sur plusieurs lignes, du bas vers le haut. Tout en bas, elles sont grandes et espacées, puis à chaque ligne au-dessus, elles deviennent plus petites. Sur le côté droit, on voit des chiffres allant de 1/10 jusqu’à 10/10, ce qui correspond au niveau de vision. Plus on arrive à lire les lettres en haut, plus l’acuité visuelle est considérée comme précise. C’est un support simple, en noir et blanc, sans aucun décor, juste là pour évaluer la capacité à voir de loin. Ce type de support est utilisé lors des tests visuels classiques chez l’ophtalmologiste.
- • de près où l’échelle de lecture, qui comporte des caractères d’imprimerie de tailles différentes, est placée à 33 cm. L’échelle la plus utilisée est celle de Parinaud (fig. 1.12), qui est constituée d’un texte dont les paragraphes sont écrits avec des caractères de taille décroissante; l’acuité visuelle de près est ainsi chiffrée de Parinaud 14 (P14) à Parinaud 1,5 (P1,5), la vision de près normale correspondant à P2.


Fig. 1.12 Échelle d’acuité visuelle de près de Parinaud. Document imprimé représentant une échelle d’acuité visuelle de près selon le test optométrique de Parinaud. Le texte est disposé en paragraphes successifs, chacun numéroté par un chiffre croissant de haut en bas (allant de 14 à 1,5), indiquant une diminution progressive de la taille des caractères. En haut de la page, il est précisé que la distance de lecture recommandée est de 33 centimètres. Le texte commence par une citation explicative, utilisée comme support pour l’évaluation de la vision de près. Dans la partie inférieure droite, une section intitulée « Indicateur Chaix » présente une série de lignes avec des caractères imprimés dans un format condensé, servant également à tester la lecture fine. Ce document est structuré pour permettre une analyse précise de l’acuité visuelle en conditions de lecture rapprochée.
L’acuité visuelle doit toujours être mesurée sans correction, puis avec correction optique éventuelle d’un trouble de la réfraction ou amétropie.
C 13Examen du segment antérieur (fig. 1.13)
Une partie de l’examen peut être réalisée de façon directe (examen de la conjonctive, recherche d’une ulcération cornéenne, réflexe photomoteur), mais un examen fin nécessite l’utilisation d’une lampe à fente. Le biomicroscope (ou « lampe à fente ») est un microscope binoculaire présentant plusieurs grossissements et permettant de voir avec détail les différents éléments du segment antérieur. Son système d’éclairage particulier est constitué par une fente lumineuse qui permet d’effectuer une coupe optique des différentes structures du segment antérieur et d’en apprécier la transparence nécessaire à la vision.

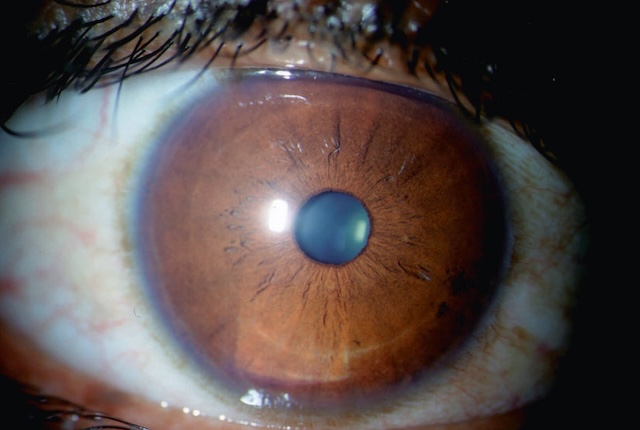
Cette photographie en gros plan montre le segment antérieur d’un œil en état physiologique normal. L’iris, de teinte brun foncé, présente une structure radiaire régulière avec un relief distinct et un stroma bien défini. La pupille est parfaitement ronde, centrée, et réagit à la lumière, ce qui reflète un tonus pupillaire conservé. La cornée est totalement transparente, sans aucune opacité visible, permettant l’observation nette des détails sous-jacents. La jonction limbe-sclère est bien dessinée et sans inflammation. Les cils ainsi que les vaisseaux conjonctivaux sont également perceptibles en périphérie, confirmant l’absence d’anomalie conjonctivale. La réflexion lumineuse uniforme à la surface cornéenne indique une bonne qualité du film lacrymal et une courbure cornéenne physiologique. Il s’agit ici d’un cliché obtenu dans un contexte clinique, probablement sous lampe à fente, pour l’évaluation normale du segment antérieur.
1 Examen de la conjonctive
- • une rougeur conjonctivale (« œil rouge ») :
- – diffuse (fig. 1.14), sans ou avec sécrétions, évoquant une conjonctivite bactérienne (fig. 1.15),

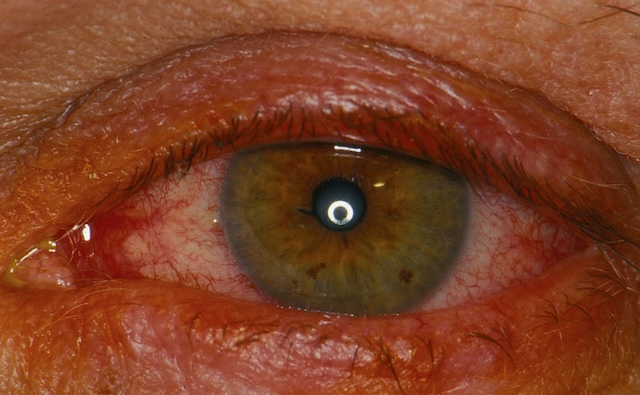
Fig. 1.14 Rougeur conjonctivale diffuse. Sur cette photo, on voit un œil dont la conjonctive est bien rouge. La rougeur est étendue, surtout visible en bas et sur le côté interne. La paupière inférieure est un peu gonflée, les vaisseaux sont bien marqués. L’iris est net, la pupille aussi. L’œil est ouvert, éclairé de face, ce qui permet de voir clairement les détails sans reflet gênant. L’image montre une inflammation visible, sans autre élément autour.

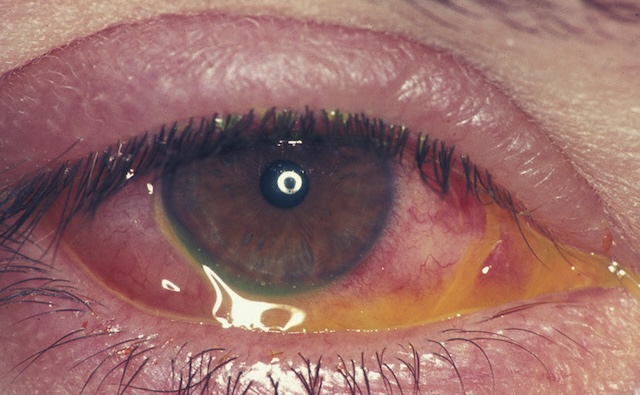
Fig. 1.15 Rougeur conjonctivale diffuse associée à des sécrétions (conjonctivite bactérienne), et une œdème conjonctival (chémosis). Photographie clinique en gros plan montrant un œil ouvert avec une conjonctive injectée, traduisant une rougeur diffuse. La teinte rougeâtre entoure l’iris et s’étend sur toute la surface visible de la conjonctive, en particulier dans la partie inférieure. Une accumulation notable de sécrétions jaune-mucopurulentes est visible dans le cul-de-sac conjonctival inférieur, s’écoulant légèrement vers l’angle interne de l’œil. La paupière inférieure apparaît légèrement gonflée, et la zone palpébrale supérieure présente aussi une légère inflammation. Le reflet lumineux rond au centre de la pupille indique un bon éclairage frontal utilisé au moment de la prise de vue. L’ensemble de l’image illustre une situation oculaire anormale avec présence de sécrétions, sans ajout d’interprétation externe.
- – localisée en plage hémorragique (par exemple hémorragie sous-conjonctivale, fig. 1.16),

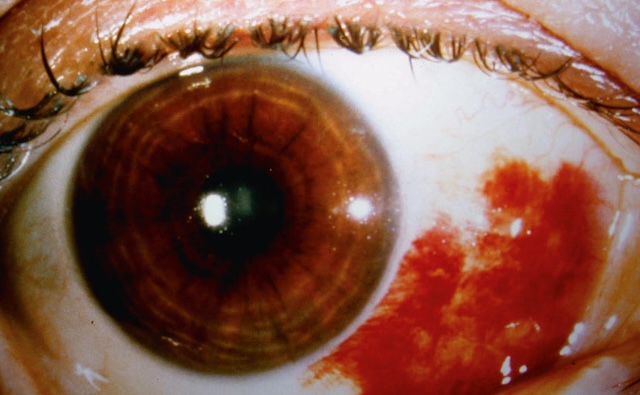
Fig. 1.16 Hémorragie sous-conjonctivale. Cette photographie en plan rapproché montre un œil atteint d'une hémorragie sous-conjonctivale. Une large nappe rouge vif s'étale sur la conjonctive bulbaire, localisée dans le quadrant temporal inférieur. Le sang est clairement confiné entre la conjonctive et la sclère, sans effraction apparente du globe oculaire. L’iris, de couleur brun foncé, reste bien visible à travers une cornée claire, tandis que la pupille est centrée et réactive à la lumière. Aucune inflammation de la cornée ni déformation pupillaire n’est observée. L’hémorragie ne semble pas douloureuse ni accompagnée de sécrétions, ce qui suggère une origine bénigne, souvent spontanée ou traumatique mineure. Les cils, paupières et autres structures périoculaires sont intactes, renforçant l’aspect localisé et superficiel du saignement. Ce cliché médical est utilisé dans le cadre d’une observation ophtalmologique de routine ou lors d’un contrôle d’un trouble vasculaire conjonctival.
- – prédominant autour du limbe sclérocornéen (« cercle périkératique ») évoquant une kératite, un glaucome aigu par fermeture de l’angle ou une uvéite antérieure (fig. 1.17 et fig. 1.18),

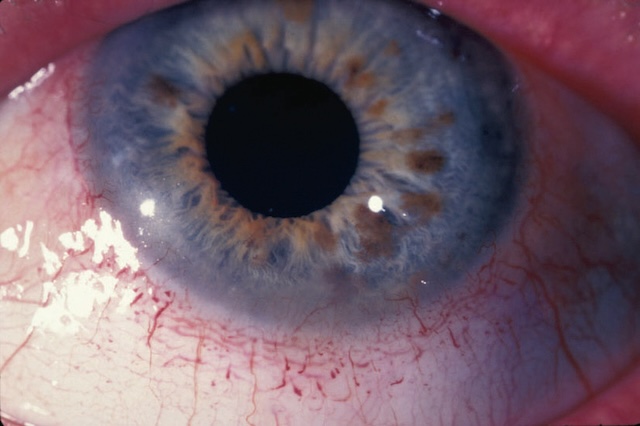
Fig. 1.17 Cercle périkératique. Photo clinique rapprochée montrant un œil avec un cercle périkératique bien visible. Autour de la cornée, on distingue une zone où les petits vaisseaux sanguins sont injectés en anneau, formant une rougeur fine mais marquée. Cette vascularisation reste concentrée près du bord cornéen, laissant le reste de la conjonctive plus clairsemée. L’iris présente des variations de couleur, allant du bleu clair à des touches plus dorées près de la pupille. L’ensemble est net, éclairé de manière uniforme, ce qui met en évidence le contraste entre les zones calmes et les vaisseaux congestionnés autour de la cornée.

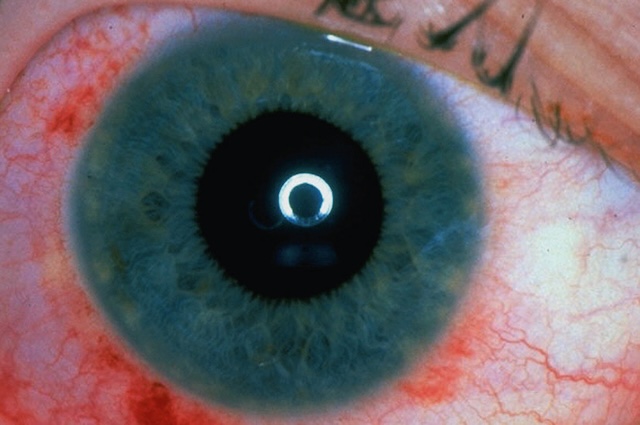
Fig. 1.18 Cercle périkératique. Photographie clinique en gros plan centrée sur un œil ouvert, montrant de manière nette un cercle périkératique. L’iris, aux teintes bleutées et verdâtres, entoure une pupille bien centrée, avec un reflet lumineux rond visible au centre. Autour de la cornée, un halo rougeâtre forme un anneau concentrique irrégulier, localisé à la jonction entre la cornée claire et la sclère, typique d’une injection ciliaire. La vascularisation est particulièrement marquée dans la région inférieure nasale, où plusieurs vaisseaux dilatés sont bien visibles, accentuant la coloration rouge de la sclère. Les cils supérieurs sont partiellement visibles, tandis que la cornée elle-même reste translucide. Cette image illustre un phénomène localisé autour de la cornée sans sécrétion apparente.
- – examen du cul-de-sac conjonctival inférieur (fig. 1.19), examen de la conjonctive palpé-brale supérieure (fig. 1.20), avec éversion de la paupière supérieure

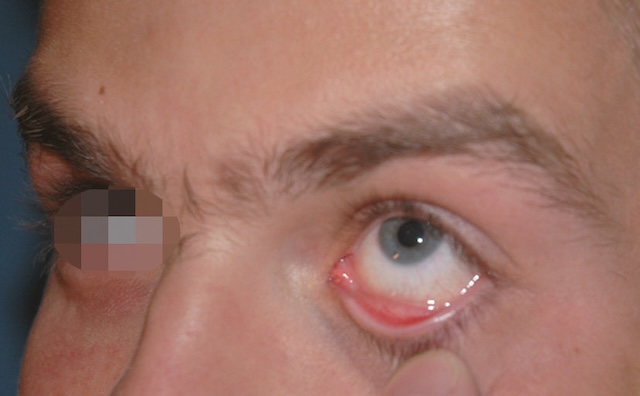
Fig. 1.19 Examen du cul-de-sac conjonctival inférieur. Sur ce cliché pris lors d’un examen ophtalmologique de routine, on voit un homme dont la paupière inférieure est légèrement abaissée à l’aide de son doigt, ce qui permet d’observer clairement la muqueuse rougeâtre du cul-de-sac conjonctival. L’œil reste ouvert vers le haut, ce qui dégage bien la zone interne à examiner. Aucune sécrétion, aucune anomalie visible ou pathologie manifeste n’apparaît sur cette zone, seulement une coloration rosée typique. L’œil paraît calme, sans signe d’irritation marquée, et les cils ainsi que la peau environnante sont en bon état. Ce genre de vue est courant dans un cadre d’examen simple, pour s’assurer qu’aucun corps étranger n’est coincé sous la paupière ou qu’aucun signe d’infection n’est présent.

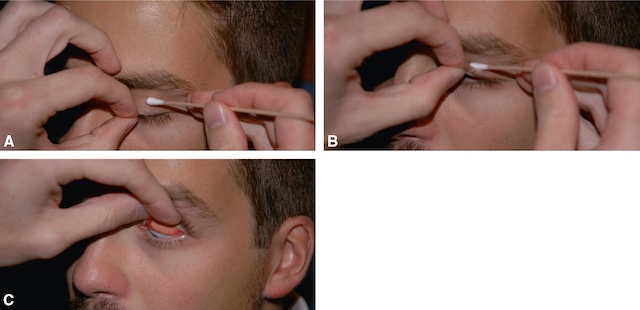
Fig. 1.20 A–C. Examen de la conjonctive palpébrale supérieure. Série photographique clinique illustrant les étapes de l’examen de la conjonctive palpébrale supérieure. Sur la première image (A), un coton-tige est appliqué doucement sur la paupière supérieure fermée, pendant que l’autre main maintient les cils vers le bas. Dans l’image B, le coton-tige exerce une légère pression alors que la paupière est en train d’être retournée avec l’aide des doigts. Enfin, sur l’image C, la paupière est complètement éversée, laissant apparaître la face interne, bien rouge et humide, qui correspond à la conjonctive palpébrale. L’éclairage est constant, le regard du patient est dirigé vers le bas, et les gestes sont précis, sans brutalité. Cette séquence montre une méthode simple et manuelle pour observer cette zone de l’œil.
- – diffuse (fig. 1.14), sans ou avec sécrétions, évoquant une conjonctivite bactérienne (fig. 1.15),
- • un œdème conjonctival ou chémosis (fig. 1.21).

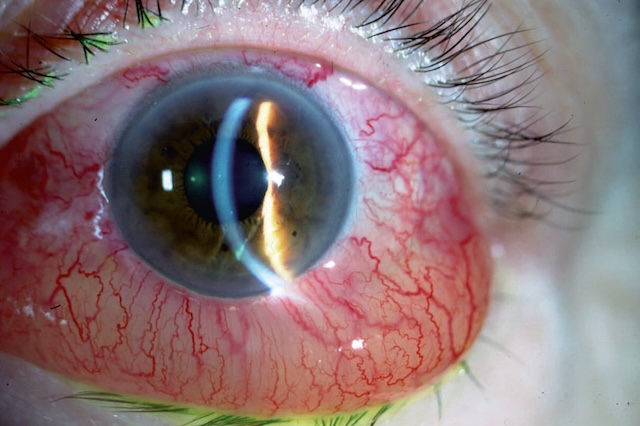
Fig. 1.21 Chémosis. Photographie clinique en gros plan d’un œil présentant un chémosis. La conjonctive apparaît nettement soulevée et œdématiée, particulièrement marquée dans la zone inférieure, avec un aspect gonflé et luisant. Une hyperhémie conjonctivale intense est visible, caractérisée par une dilatation diffuse et sinueuse des vaisseaux sanguins, s’étendant sur toute la surface de la sclère exposée. La cornée reste transparente et laisse entrevoir l’iris brun et une pupille noire bien centrée. Une bande lumineuse verticale traverse la cornée, suggérant un éclairage par lampe à fente utilisé lors de la prise de vue. Les cils supérieurs et inférieurs sont bien visibles, avec quelques reflets de lumière sur la conjonctive œdématiée, accentuant l’effet de gonflement.
2 141516Examen de la cornée
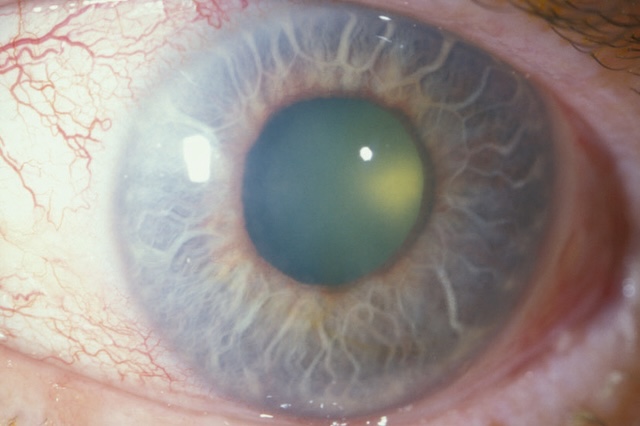
La transparence cornéenne peut être diminuée de façon diffuse par un œdème cornéen (par exemple glaucome aigu, fig. 1.22) ou de façon localisée par une ulcération cornéenne (aspect dépoli) ou une kératite (zone blanchie) (fig. 1.23 et fig. 1.24).

Ce cliché clinique montre un gros plan de l’œil avec une cornée présentant une perte marquée de transparence. La surface cornéenne semble brumeuse et trouble, masquant partiellement l’iris et la pupille. On observe également une vascularisation conjonctivale injectée sur le côté gauche de l’œil, signe d’irritation ou de congestion. La turbidité diffuse de la cornée est typique d’un œdème cornéen, souvent associé à une poussée de glaucome aigu, lorsque la pression intraoculaire augmente soudainement, altérant la perméabilité et la clarté de la cornée. L’image capte avec précision l’aspect voilé et la perte de limpidité, éléments clés à l’examen ophtalmologique.

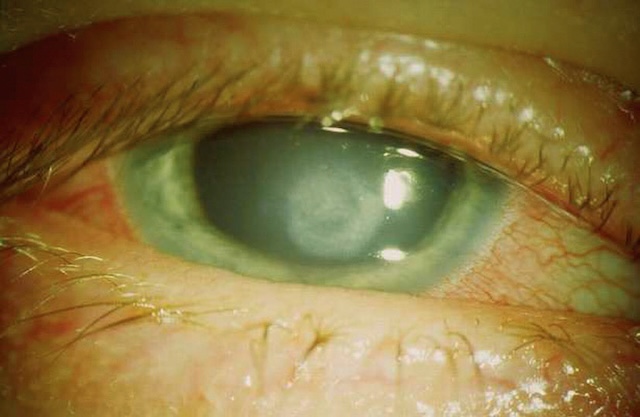
Photo clinique en gros plan d’un œil présentant une perte de transparence localisée au niveau de la cornée. La zone centrale apparaît blanchâtre et floue, contrastant nettement avec les tissus environnants plus clairs. La surface cornéenne ne reflète plus la lumière de manière uniforme, et l’aspect brillant habituel est altéré à cet endroit. La rougeur conjonctivale est visible en périphérie, surtout du côté nasal et inférieur, avec des vaisseaux marqués. Les paupières sont légèrement gonflées, mais ce qui attire l’attention, c’est cette opacification en plein centre, qui évoque une lésion cornéenne. L’image est nette, bien éclairée, et montre de manière directe un signe typique d’ulcération.

Photographie clinique rapprochée d’un œil présentant une atteinte cornéenne localisée. L’iris vert est bien visible avec une pupille centrale sombre, et au centre de la cornée, une zone irrégulière blanchâtre, légèrement surélevée, attire l’attention. Cette lésion contraste avec la transparence habituelle de la cornée et évoque une ulcération bien circonscrite. Autour de cette zone, plusieurs reflets lumineux accentuent le relief de la surface altérée. La sclère environnante montre une hypervascularisation notable, avec des vaisseaux rouges sinueux convergeant vers la périphérie cornéenne. Les bords palpébraux inférieurs et supérieurs sont partiellement visibles, encadrant un œil clairement inflammé.
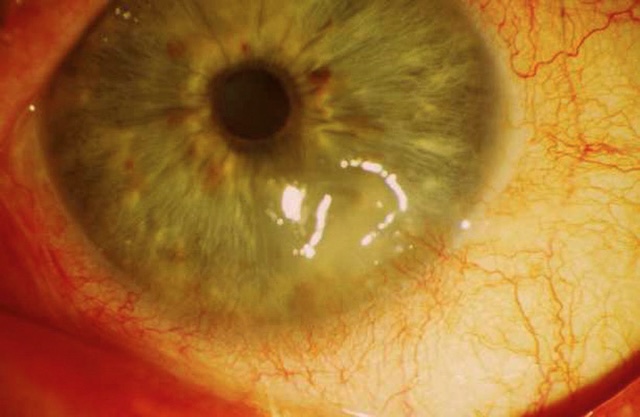
17L’instillation d’une goutte de fluorescéine permet de mieux visualiser une ulcération cornéenne, notamment si on l’examine avec une lumière bleue qui fait apparaître l’ulcération en vert (fig. 1.25 et fig. 1.26).


Ce cliché ophtalmologique met en évidence une ulcération cornéenne révélée par l’application d’un collyre à la fluorescéine. On observe une zone de coloration vert intense sur la surface cornéenne, signe classique d’une atteinte de l’épithélium. Cette zone irrégulière, bien délimitée au centre de la cornée, montre une perte de continuité de l’épithélium, exposée à la coloration. Autour, l’iris et la pupille sont encore visibles, bien que la présence d’un léger flou périphérique et une injection conjonctivale indiquent une irritation locale. Ce type de visualisation est utilisé en pratique pour identifier la localisation, la taille et la forme d’un ulcère, notamment dans le cadre d’une kératite.

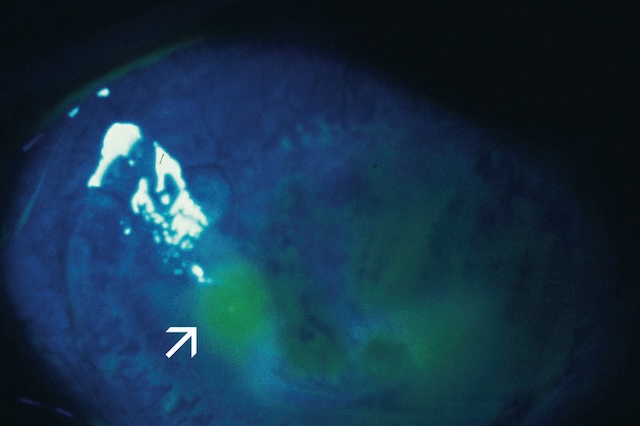
Ce cliché ophtalmologique réalisé en lumière bleue met en évidence une ulcération cornéenne après instillation d’un collyre à base de fluorescéine. La lumière bleue fait ressortir une zone verdâtre irrégulière marquée par une flèche blanche, traduisant une lésion de l’épithélium cornéen. Cette zone, localisée dans le quadrant inférieur de la cornée, montre une perte de transparence et une imprégnation caractéristique du colorant. L’environnement de la cornée présente un halo diffus témoignant d’une inflammation active. L’ensemble est typique d’une atteinte cornéenne superficielle nécessitant un suivi ophtalmologique précis.
4 Examen de la chambre antérieure
- • des signes inflammatoires :
- – présence de cellules inflammatoires et de protéines circulant dans l’humeur aqueuse : « phénomène de Tyndall »,
- – dépôts de cellules inflammatoires à la face postérieure de la cornée : « précipités rétro-cornéens » (fig. 1.27),

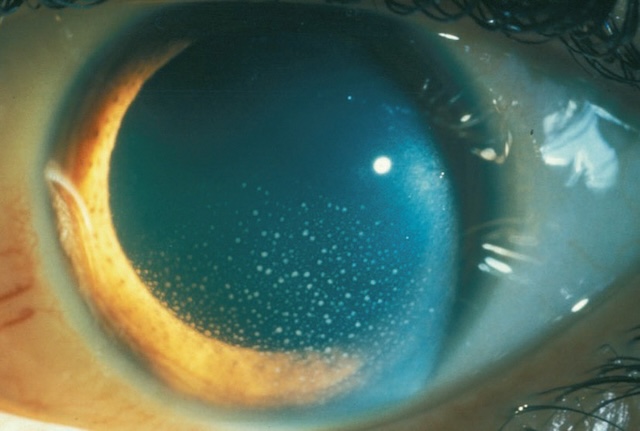
Fig. 1.27 Précipités rétrocornéens. Sur cet examen ophtalmologique en lumière focalisée, on distingue nettement la présence de multiples précipités rétrocornéens disposés à la face postérieure de la cornée. Ces dépôts, de petite taille et répartis de manière diffuse, se présentent sous forme de points blanchâtres légèrement opaques, typiques d’un processus inflammatoire intraoculaire, comme une uvéite antérieure. La chambre antérieure est visible, et l’éclairage oblique révèle une transparence altérée localement par la dispersion des précipités. La limbe, l’iris et la pupille sont bien visualisés en arrière-plan, sans signe de synéchie. Cette observation permet d’orienter le diagnostic vers une inflammation chronique ou subaiguë de l’uvée antérieure.
- – adhérences inflammatoires entre face postérieure de l’iris et capsule antérieure du cristallin (« synéchies iridocristalliniennes » ou « synéchies postérieures », fig. 1.28) responsables d’une déformation pupillaire;


Fig. 1.28 Synéchies iridocristalliniennes. Cette photographie du segment antérieur de l’œil illustre la présence de synéchies iridocristalliniennes. L’iris présente une attache anormale à la capsule antérieure du cristallin, visible ici par une déformation de la pupille qui apparaît irrégulière et asymétrique. La coloration brune de l’iris reste identifiable, mais l’adhérence modifie nettement la forme pupillaire, ce qui est typique d’un antécédent inflammatoire intraoculaire. Les vaisseaux conjonctivaux sont dilatés, signalant une hyperhémie conjonctivale souvent associée à une uvéite. L’observation met en évidence une pathologie post-inflammatoire, soulignant une perte de mobilité pupillaire et un risque potentiel d’augmentation de la pression intraoculaire si non traitée.
- • la présence de pus dans la chambre antérieure : « hypopion » (fig. 1.29);

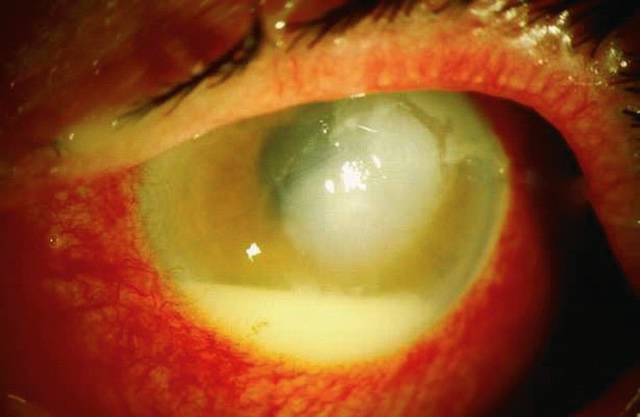
Fig. 1.29 Hypopion. Cette photographie clinique en lumière focalisée illustre un œil présentant un hypopion, identifié par l’accumulation visible d’un exsudat blanchâtre au niveau de la chambre antérieure, décanté en position déclive. Ce dépôt inflammatoire est souvent associé à une kératite infectieuse ou à une uvéite sévère. La cornée, elle, apparaît trouble et infiltrée, réduisant la transparence habituelle. L’intensité de la rougeur conjonctivale périphérique, particulièrement marquée autour de la cornée, évoque une hyperhémie importante. Ce type d’aspect suggère une réponse inflammatoire aiguë, et constitue une urgence ophtalmologique nécessitant une prise en charge rapide.
- • la présence de sang dans la chambre antérieure : « hyphéma » (fig. 1.30).

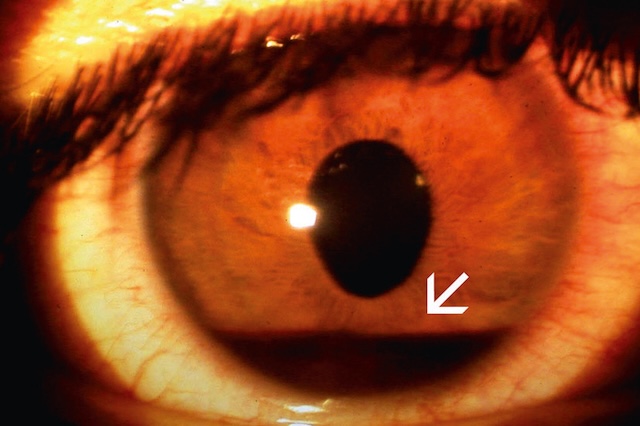
Fig. 1.30 Hyphéma. L’image présente un gros plan du segment antérieur d’un œil atteint d’un hyphéma, c’est-à-dire une accumulation de sang visible dans la chambre antérieure, entre la cornée et l’iris. Le dépôt hématique apparaît comme une ligne horizontale rouge au bas de l’iris, avec un niveau bien défini, indiquant la sédimentation du sang. Le reste de l’œil révèle une sclère injectée et une cornée claire, laissant apparaître l’hémorragie. Cette présentation est souvent la conséquence d’un traumatisme oculaire, et son observation en consultation nécessite une attention urgente pour éviter les complications telles que l’hypertonie intraoculaire ou une atteinte visuelle prolongée.
D 1920Mesure de la pression intraoculaire
La mesure de la pression intraoculaire (PIO) ou tonus oculaire (TO) peut être effectuée de deux façons :
- • soit à l’aide d’un tonomètre à aplanation installé sur la lampe à fente (fig. 1.31 et fig. 1.32); son principe est de déterminer le TO en appliquant une dépression sur la cornée;


Fig. 1.31 A, B. Examen du segment antérieur à la lampe à fente. Sur la première image, on distingue une lampe à fente positionnée sur une table d’examen, utilisée pour explorer en détail les structures visibles de l’œil. L’appareil comporte un repose-menton et un appui frontal pour maintenir la tête stable, ainsi qu’un système optique permettant une observation précise en lumière dirigée. Sur la seconde image, un patient est assis face à cet appareil, le regard fixé droit devant lui, tandis qu’un professionnel de santé réalise un examen oculaire en observant à travers l’oculaire. Le praticien règle probablement l’éclairage en fente pour explorer couche par couche la cornée, la chambre antérieure ou l’iris, avec minutie. Le contexte évoque une scène classique de consultation spécialisée, où cette procédure est essentielle pour détecter d’éventuelles anomalies du segment antérieur.

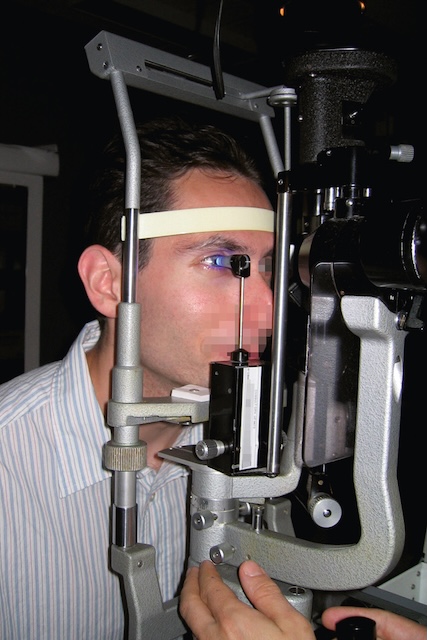
Fig. 1.32 Mesure du tonus oculaire par aplanation. Un homme est installé devant une lampe à fente équipée d’un tonomètre d’aplanation pour la mesure du tonus oculaire. Son menton repose sur le support adapté, et son front est maintenu contre une bande frontale pour stabiliser sa tête. Un faisceau lumineux bleuté est projeté sur la cornée, indiquant l’utilisation d’un colorant à la fluorescéine afin d’optimiser la lecture de la pression intraoculaire. L’examinateur ajuste l’appareil avec précision, plaçant délicatement la sonde tonométrique contre la cornée pour mesurer la pression exercée par l’humeur aqueuse. Cette technique est essentielle pour évaluer le risque de glaucome ou suivre son évolution. Le patient reste immobile, les yeux ouverts, coopérant pleinement avec l’opérateur pour garantir la fiabilité du résultat.
- • soit à l’aide d’un tonomètre à air pulsé, qui est devenu la méthode la plus utilisée.
Le TO normal se situe le plus souvent entre 10 et 20 mmHg; on parle d’hypertonie oculaire pour une PIO supérieure ou égale à 22 mmHg.
Le TO peut également être apprécié par la palpation bidigitale; celle-ci ne donne cependant qu’une approximation et n’a en pratique de valeur qu’en cas d’élévation très importante du TO.
E 21Gonioscopie
On pratique parfois un examen de l’angle iridocornéen (fig. 1.33) ou gonioscopie, qui est réalisée à la lampe à fente à l’aide d’un verre de contact comportant un miroir permettant d’apprécier les différents éléments de l’angle iridocornéen (voir chapitre 14).

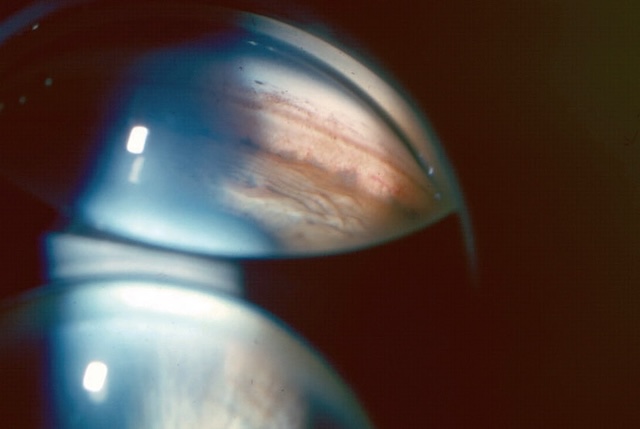
Cette photographie correspond à un examen en gonioscopie permettant de visualiser directement l’angle formé entre la cornée et l’iris, appelé angle iridocornéen. À travers le miroir utilisé pour cette technique, on observe un angle clairement ouvert, sans signe d’adhérences ni d’obstruction. Les structures comme le trabéculum apparaissent nettes, légèrement pigmentées, et la transition vers la sclère est visible. L’iris, quant à lui, présente une implantation régulière, sans bombement ni fermeture progressive. Ce type d’examen est essentiel dans l’évaluation du drainage de l’humeur aqueuse, notamment dans le suivi ou le dépistage des glaucomes.
F 22Examen du fond d’œil (fig. 1.34)
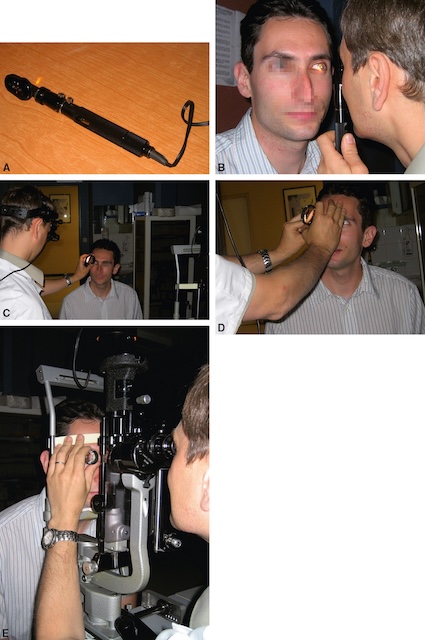
1 Méthodes d’examen (fig. 1.35)
Le fond d’œil peut être observé en ophtalmoscopie directe au lit du malade mais ne donne qu’une vision restreinte du pôle postérieur. Le fond d’œil est aussi accessible à l’aide d’un casque grossissant de Schepens ambulatoire ou avec une lampe à fente fixe, en interposant une lentille tenue à la main sans contact ou posée directement sur la surface de l’œil du patient. Ces techniques indirectes permettent une analyse très fine des détails du fond d’œil.

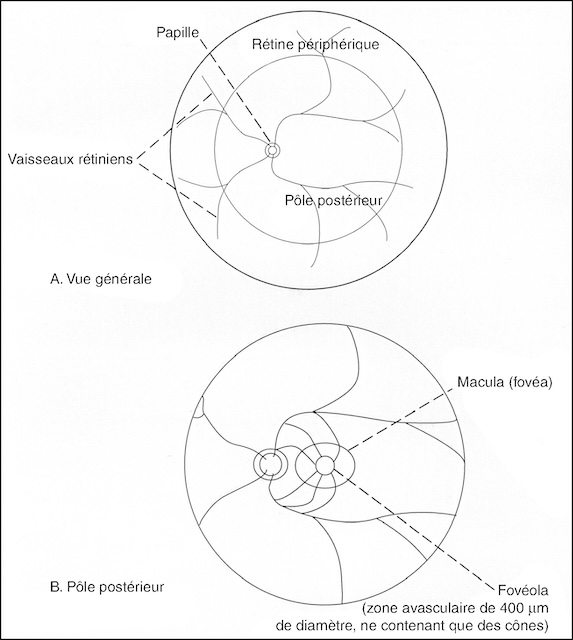
Ce schéma en deux parties propose une visualisation simplifiée du fond d’œil, illustrant d’abord une vue générale de la rétine, puis un agrandissement du pôle postérieur. La première représentation met en évidence la papille optique, les vaisseaux rétiniens qui en émergent, ainsi que la rétine périphérique entourant le pôle postérieur. La seconde vue se concentre sur la région centrale du fond d’œil, soulignant la macula et sa zone centrale, la fovéola, une aire avasculaire d’environ 400 µm de diamètre exclusivement constituée de cônes. Cette zone est essentielle à la vision fine et détaillée. Le contraste entre les zones vascularisées et avasculaires de la rétine est clairement délimité, renforçant l’importance fonctionnelle de cette région centrale pour la perception visuelle.

A, B. Ophtalmoscopie directe. C, D. Ophtalmoscopie binoculaire indirecte. E. Biomicroscopie du fond d’œil à la lampe à fente.
L’ensemble des clichés présente différentes techniques cliniques utilisées pour l’examen du fond d’œil. Sur la première vue (A), on observe un ophtalmoscope direct, outil portatif doté d’une lumière orange à son extrémité, utilisé en consultation. L’image suivante (B) montre son application directe : le praticien examine un patient en tenant l’appareil devant son œil, la lumière étant dirigée à travers la pupille. Les images C et D illustrent l’utilisation d’un ophtalmoscope indirect avec une lentille tenue à la main, tandis que le professionnel porte une lampe frontale afin de projeter une lumière intense dans l’œil du patient. Enfin, l’image E montre l’usage d’une lampe à fente, dispositif posé sur une table, avec un appui mentonnier, permettant une observation approfondie et stabilisée des structures internes de l’œil. Chacune de ces méthodes correspond à un examen ophtalmique précis, permettant une visualisation directe de la rétine, du nerf optique et des vaisseaux rétiniens. L’équipement et la posture du patient sont bien visibles, et chaque méthode s’adapte à une indication clinique spécifique.
Le fond d’œil est aujourd’hui relativement facile d’accès à l’aide de rétinographe non mydria-tique (appareil permettant la réalisation d’une photographie du fond d’œil sans dilatation pupillaire) ou un simple smartphone avec une lentille adaptée.
2 2324Aspect du fond d’œil normal (fig. 1.36)
a Examen du pôle postérieur
Cet examen amène à décrire trois éléments principaux :

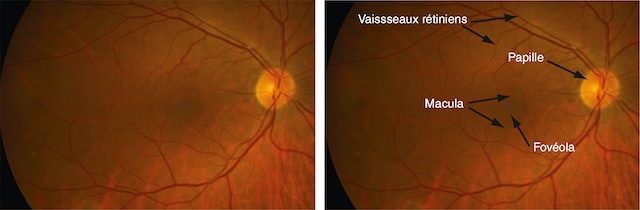
Le fond d’œil présenté ici montre une vue nette de la rétine gauche avec ses structures bien visibles. À droite de l’image, la papille optique se distingue par sa couleur claire et arrondie, point d’émergence des vaisseaux rétiniens qui se ramifient en direction des différentes zones de la rétine. Vers la gauche, on remarque une zone plus pigmentée, la macula, avec en son centre un point légèrement plus sombre : la fovéola. L’ensemble du champ rétinien est uniformément orangé, sans tache ni lésion apparente. Les deux vues, dont l’une est annotée, permettent d’identifier précisément les régions essentielles de l’œil, utiles pour évaluer l’état général de la vision centrale et périphérique.
- • la papille, qui correspond anatomiquement à la tête du nerf optique (et à la tache aveugle à l’examen du champ visuel), et qui est formée par la réunion des fibres optiques. Elle se présente comme un disque clair à bords nets, comportant une excavation physiologique au fond de laquelle apparaissent l’artère et la veine centrales de la rétine;
- • les vaisseaux rétiniens qui se divisent pour vasculariser la surface rétinienne interne. Les branches veineuses sont plus sombres, plus larges et plus sinueuses que les branches artérielles dont elles suivent grossièrement le trajet;
- • la macula (fovéa), située à proximité et en dehors de la papille. Région très riche en cônes, elle permet la vision des détails; c’est une zone ovalaire d’environ 1,5 sur 1 mm (taille sensiblement identique à celle de la papille). Elle est centrée par une zone avasculaire ne contenant que des cônes, zone essentielle permettant la vision des détails, apparaissant plus sombre, de 400 µm de diamètre, et appelée fovéola.
3 Lésions élémentaires du fond d’œil
a Microanévrismes rétiniens (fig. 1.37)
Les microanévrismes rétiniens apparaissent sous forme de points rouges de petite taille. Ils siègent sur les capillaires rétiniens et se remplissent de fluorescéine sur l’angiographie du fond d’œil (voir plus loin). Ils sont un des éléments de la rétinopathie diabétique.

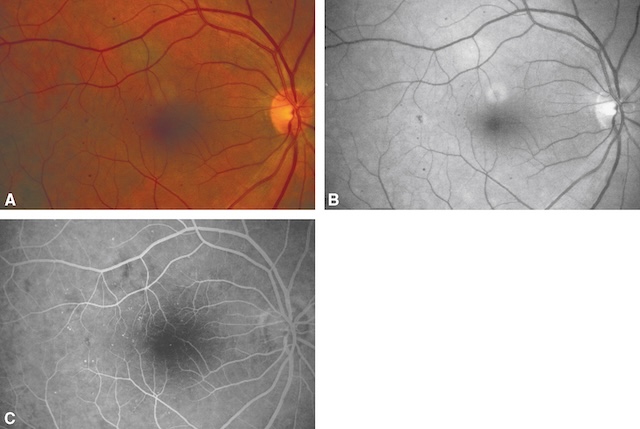
A. Rétinographie en couleur. B. Angiographie, cliché sans préparation. C. Angiographie, cliché après injection : remplissage des microanévrismes par la fluorescéine.
Les trois photographies de fond d’œil montrent différentes représentations de la microangiopathie rétinienne. La première image (A), en couleurs, dévoile un fond d’œil où la macula est entourée de microanévrismes visibles sous forme de minuscules taches sombres, avec un disque optique bien défini à droite. L’image B, en noir et blanc, offre un contraste accentué des structures vasculaires, mettant mieux en évidence les zones sombres centrales associées à des altérations microvasculaires. Enfin, l’image C, prise par angiographie à la fluorescéine, illustre clairement un réseau capillaire irrégulier avec un centre hyperfluorescent, soulignant une perméabilité accrue et une microcirculation perturbée. Ce type de photographie de fond d’œil permet une lecture directe des signes précoces d’une rétinopathie.
b 25Hémorragies du fond d’œil
- • les hémorragies intravitréennes (fig. 1.38 et fig. 1.39);

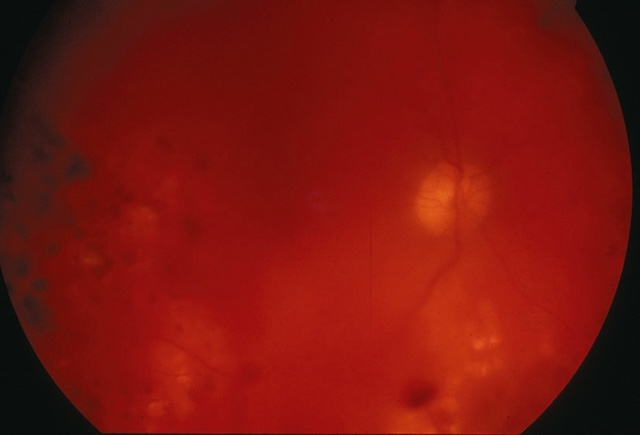
Fig. 1.38 Hémorragie intravitréenne modérée, laissant voir la rétine. Cette photographie en fond d’œil obtenue par examen rétinien met en évidence une hémorragie intravitréenne modérée. Bien que le vitré soit envahi partiellement par du sang, les structures rétiniennes profondes restent en partie visibles, notamment la papille optique et le trajet de quelques vaisseaux rétiniens. La diffusion du sang est irrégulière, avec des zones plus denses parsemées de plages floues rouge foncé, traduisant la présence de sang diffus dans le vitré. L'ensemble du champ visuel apparaît voilé, mais sans obstruction totale, ce qui suggère un saignement de degré moyen. Ce type de présentation est souvent associé à une rétinopathie diabétique, une déchirure ou un décollement rétinien.

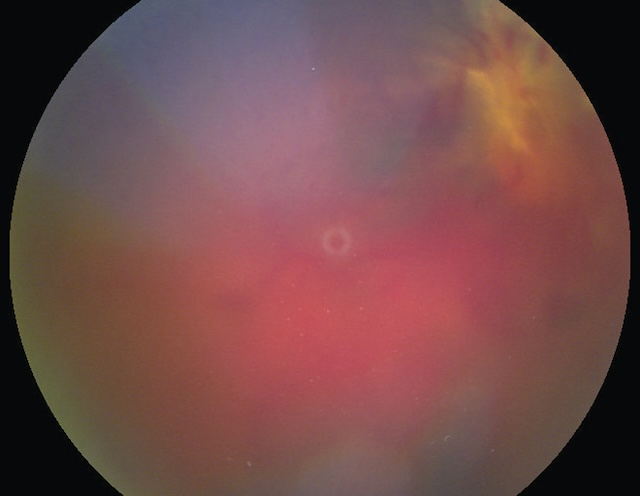
Fig. 1.39 Hémorragie intravitréenne massive. Cette vue de fond d’œil obtenue par imagerie rétinienne met en évidence une hémorragie intravitréenne massive, occupant l’ensemble de la cavité vitréenne et masquant les repères habituels comme les vaisseaux rétiniens, la papille ou la macula. La surface apparaît intensément saturée de tons rouges et violacés, avec une dominance hématique homogène au centre du champ. Une légère zone plus claire, circulaire et centrée, évoque un reliquat de transparence localisée, probablement au niveau de la fovéa. L’opacité globale du vitré rend impossible la visualisation nette des structures du pôle postérieur. Cette présentation suggère une rupture vasculaire sévère dans la cavité vitréenne, potentiellement associée à une pathologie vasculaire rétinienne ou à une complication post-traumatique. L’image traduit une obstruction dense de l’axe visuel, nécessitant une prise en charge urgente.
- • les hémorragies prérétiniennes, qui masquent les vaisseaux rétiniens (fig. 1.40);

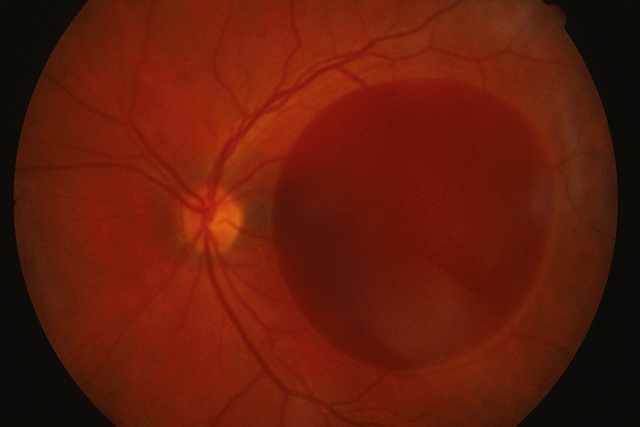
Fig. 1.40 Hémorragie prérétinienne masquant les vaisseaux rétiniens. L’examen du fond d’œil montre une large nappe rouge foncé occupant la zone centrale droite, dissimulant les vaisseaux rétiniens habituellement visibles dans cette région. Cette étendue sombre, bien arrondie et homogène, contraste nettement avec les structures avoisinantes plus orangées. On remarque que la papille optique est visible à gauche, légèrement excentrée, avec quelques vaisseaux rétiniens principaux partant de son centre. Le reste du fond d’œil conserve une coloration régulière et un réseau vasculaire identifiable, sauf à l’endroit exact où le saignement est venu se superposer. Cette image obtenue à partir d’un examen du fond d’œil évoque une accumulation de sang devant la rétine, probablement sous forme d’un voile prérétinien, rendant cette zone visuellement obstruée.
- • les hémorragies sous-rétiniennes (fig. 1.41);

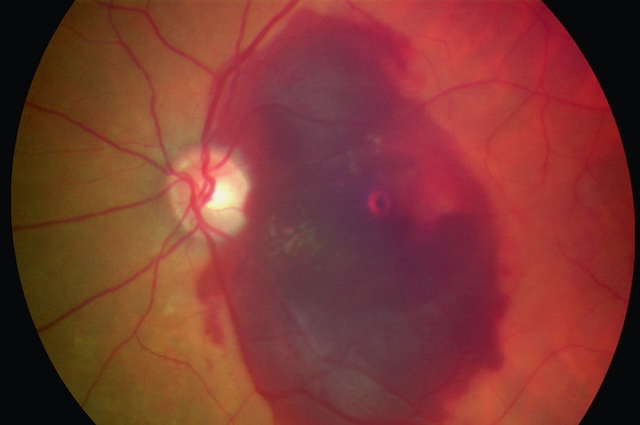
Fig. 1.41 Hémorragie sous-rétinienne (ne masque pas les vaisseaux rétiniens). Sur cette photographie prise lors d’un examen du fond d’œil, on observe une large hémorragie sous-rétinienne, bien marquée au centre de la rétine. Elle s'étale de manière asymétrique autour de la macula, formant une tache foncée aux contours irréguliers, avec des nuances rouge sombre. Malgré cette accumulation de sang, les vaisseaux rétiniens qui traversent la zone atteinte restent partiellement visibles, ce qui indique que le saignement se situe en dessous de la rétine et non à sa surface. La papille optique est bien distincte sur le côté gauche de l’image, ronde et de teinte claire, ce qui confirme qu’elle n’est pas directement touchée. La configuration et la distribution du saignement orientent vers une origine vasculaire localisée sous la rétine, possiblement en lien avec une rupture vasculaire profonde ou une atteinte choroïdienne.
- • 2627les hémorragies intrarétiniennes :
- – hémorragies rétiniennes punctiformes : elles ont un aspect analogue aux microanévrismes et il est parfois difficile de les distinguer (fig. 1.42),

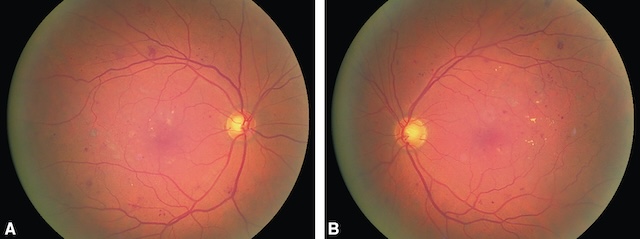
Fig. 1.42 A, B. Hémorragies punctiformes (+ quelques exsudats profonds). Ces deux photographies du fond d’œil illustrent des anomalies rétiniennes caractéristiques observées chez deux patients différents. Sur la première image (Partie A), prise à l’aide d’une photographie du fond d’œil, on distingue de nombreuses hémorragies punctiformes réparties dans l’aire maculaire, avec une coloration rouge sombre bien délimitée. On note également la présence de quelques exsudats profonds, visibles sous forme de dépôts jaunâtres plus diffus, situés à proximité de la macula. L’arbre vasculaire semble relativement conservé, bien qu’on observe une certaine diffusion des petits vaisseaux. Dans la deuxième image (Partie B), le fond d’œil révèle une répartition similaire d’hémorragies punctiformes, bien que légèrement moins denses, ainsi que des exsudats lipidiques plus marqués vers la région temporale de la macula, traduisant une atteinte vasculaire chronique de type rétinopathie. La papille optique est bien nette, ronde, sans signe d’œdème. Ces deux images évoquent une atteinte bilatérale à un stade modéré, nécessitant un suivi ophtalmologique attentif afin de prévenir d’éventuelles complications maculaires ou néovasculaires.
- – hémorragies en flammèches (elles siègent dans le plan des fibres optiques, fig. 1.43),

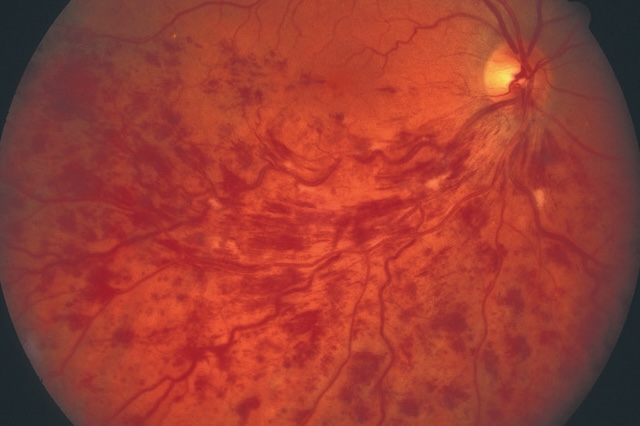
Fig. 1.43 Hémorragies en flammèches. Photographie du fond d'œil révélant plusieurs hémorragies en flammèches disposées le long des fibres nerveuses rétiniennes. Les traînées rouges allongées sont bien visibles, orientées selon la disposition radiaire autour de la papille optique, située en haut à droite de l’image. Les vaisseaux rétiniens paraissent dilatés et irréguliers, avec une trame vasculaire dense marquée par des foyers sombres d’hémorragies plus profondes. L’ensemble traduit une atteinte marquée de la rétine au niveau vasculaire, sans obstruction apparente du nerf optique.
- – hémorragies profondes, volumineuses, « en taches » (fig. 1.44).

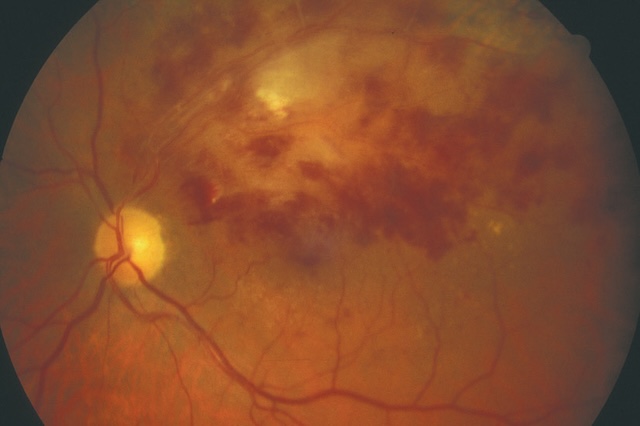
Fig. 1.44 Volumineuses hémorragies profondes, en taches (+ nodules cotonneux). Cette photographie couleur du fond d’œil révèle une atteinte rétinienne sévère caractérisée par la présence de volumineuses hémorragies profondes disposées en taches irrégulières, particulièrement concentrées dans la région temporale supérieure. Ces hémorragies, d’un rouge foncé dense, coexistent avec des nodules cotonneux blanchâtres, situés dans les couches superficielles de la rétine. La papille optique reste visible en temporal interne, de teinte jaune pâle, avec un réseau vasculaire rétinien montrant des trajets légèrement déformés, probablement en lien avec l’œdème adjacent. L’aspect diffus et étendu des lésions suggère un processus ischémique ou inflammatoire marqué, fréquemment rencontré dans des contextes de rétinopathie hypertensive, diabétique ou infectieuse avancée. L’hétérogénéité des couleurs et la disposition anarchique des saignements et exsudats renforcent l’aspect pathologique avancé visible sur cette imagerie rétinienne.
- – hémorragies rétiniennes punctiformes : elles ont un aspect analogue aux microanévrismes et il est parfois difficile de les distinguer (fig. 1.42),
c 28Nodules cotonneux
Autrefois dénommés « nodules dysoriques », les nodules cotonneux sont des lésions blanches, superficielles (au-dessus du plan des vaisseaux rétiniens) et de petite taille. Ils correspondent à l’accumulation de matériel axoplasmique dans les fibres optiques. Ils traduisent une occlusion des artérioles précapillaires rétiniennes (fig. 1.45), comme dans l’occlusion de la veine centrale de la rétine (OVCR) ou la rétinopathie diabétique.

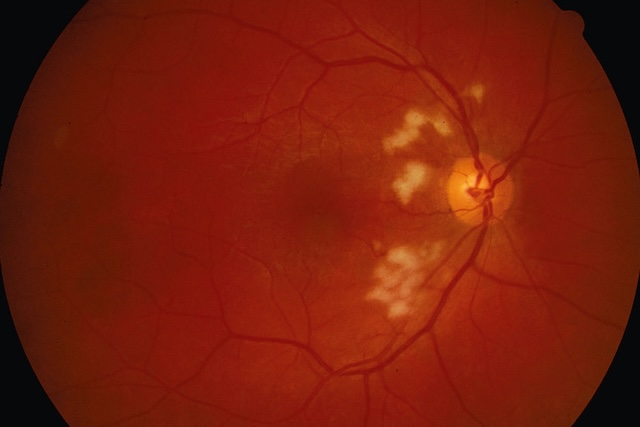
Ce fond d’œil révèle plusieurs zones blanchâtres floues, disposées principalement à droite de la papille optique, qui apparaît en ton jaune-orangé bien défini. Ces zones blanchies, aux contours irréguliers et au centre cotonneux, semblent légèrement surélevées par rapport à la rétine environnante, créant un effet de relief diffus. Les vaisseaux rétiniens adjacents, bien que visibles, contournent parfois ces formations, traduisant une interaction locale. La coloration globale du fond rétinien reste rouge-orangé uniforme, avec un réseau vasculaire relativement bien conservé, mis à part les segments proches de ces taches. L’ensemble de la scène correspond à une imagerie en coupe de la rétine, typiquement issue d’un fond d’œil ou d’une rétinographie en lumière directe.
d Exsudats profonds
Autrefois dénommés « exsudats secs », il s’agit d’accumulations de lipoprotéines dans l’épaisseur de la rétine, qui apparaissent sous forme de dépôts jaunâtres (fig. 1.46 et fig. 1.47). Ils se rencontrent plutôt dans la DMLA.

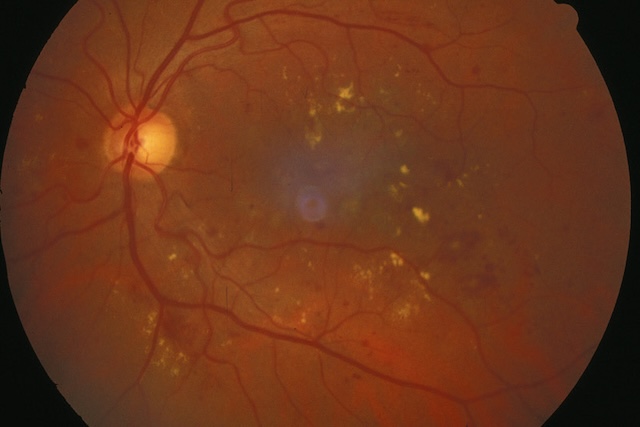
Cette photographie du fond d’œil met en évidence une accumulation marquée d’exsudats profonds, principalement concentrés autour de la région maculaire. Ces exsudats apparaissent sous forme de taches jaunâtres, irrégulièrement réparties, reflétant une atteinte vasculaire de la rétine probablement liée à une rétinopathie. La macula présente une teinte bleutée en son centre, ce qui pourrait indiquer un œdème ou un trouble de la transparence rétinienne. Les vaisseaux rétiniens demeurent bien visibles, notamment les ramifications artérielles et veineuses s'étendant à partir de la papille optique, qui est elle-même bien délimitée à gauche, avec une coloration normale. La présence diffuse de dépôts lipidiques indique une souffrance chronique de la microcirculation rétinienne.


Cette photographie de fond d’œil met en évidence une atteinte vasculaire rétinienne marquée par la présence d’exsudats profonds, bien localisés dans la partie supérieure de la région maculaire. La rétine présente une teinte brun orangé homogène, traversée par un réseau vasculaire bien visible. La papille optique, à gauche de l’image, conserve une forme ronde et un contour net, indiquant l’absence d’œdème papillaire. Dans la zone maculaire centrale, une discrète baisse de transparence est perceptible, tandis qu’au-dessus de cette région, on observe des dépôts lipidiques jaunâtres regroupés, évoquant une fuite vasculaire chronique. Ces signes traduisent souvent une rétinopathie d’origine métabolique, comme dans le cas du diabète, et justifient un suivi régulier ainsi qu’un bilan étiologique adapté. L’orientation et la netteté de l’image permettent une visualisation précise des zones touchées, rendant ce cliché fondamental pour le diagnostic et la surveillance des lésions évolutives de la macula.
e 29œdème papillaire
La papille est hyperhémiée, à bords flous.
- • Un œdème papillaire unilatéral, avec baisse d’acuité visuelle, évoque une cause vasculaire, notamment s’il s’associe à des hémorragies en flammèches (fig. 1.48).

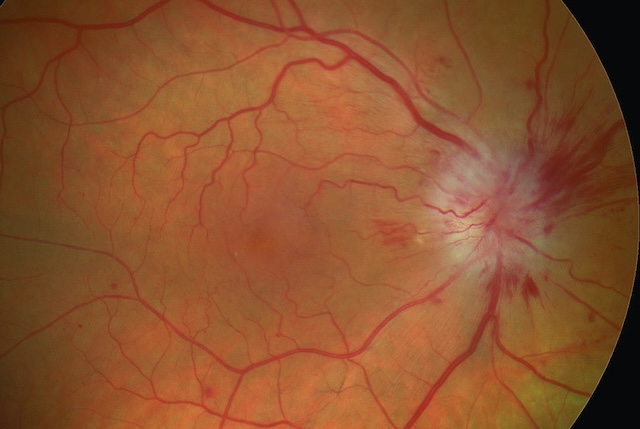
Fig. 1.48 œdème papillaire associé à des hémorragies en flammèches (neuropathie optique ischémique). L’image du fond d’œil révèle un œdème papillaire important, clairement observable par le gonflement blanchâtre autour de la tête du nerf optique, située à droite de l’image. Ce gonflement est associé à des hémorragies en flammèches qui s’étendent en périphérie de la papille, suivant les fibres nerveuses rétiniennes. Les vaisseaux sanguins rétiniens apparaissent congestifs et légèrement tortueux, témoignant d’une altération circulatoire locale. L’ensemble de ces signes suggère une neuropathie optique ischémique avec atteinte inflammatoire et vasculaire aiguë du nerf optique, traduite par un aspect flou de ses contours et une hyperhémie papillaire.
- • Un œdème papillaire bilatéral, sans baisse d’acuité visuelle, évoque une hypertension intra-crânienne (fig. 1.49) ou une hypertension artérielle sévère.

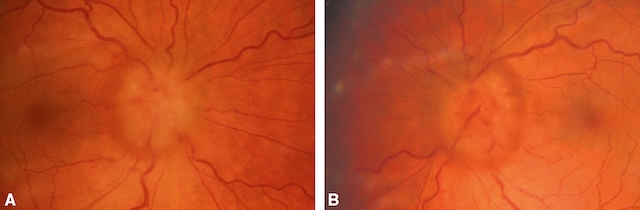
Fig. 1.49 A, B. œdème papillaire bilatéral (hypertension intracrânienne). Les deux images présentées illustrent un œdème papillaire bilatéral observé au fond d’œil. Sur l’image A comme sur la B, la papille optique est floue, ses bords sont estompés, et les vaisseaux qui en émergent semblent affaissés et tortueux, signe caractéristique d’un gonflement. On note également un léger flou péri-papillaire et une perte de la dépression physiologique centrale, remplacée par un bombement discret. L’uniformité de la couleur orangée est rompue par des zones de trouble qui accentuent la perception d’une élévation locale. Cette apparence est typique d’une hypertension intracrânienne, dont la répercussion directe sur le nerf optique provoque cet engorgement bilatéral. Ce type de présentation doit toujours alerter sur une pression intracrânienne anormalement élevée.
III 30Examens complémentaires
Dans certaines circonstances, l’ophtalmologiste aura recours à des explorations plus approfondies.
A Étude des fonctions visuelles
Le champ visuel est la portion de l’espace embrassé par l’œil regardant droit devant lui et immobile.
L’examen du champ visuel (ou périmétrie) étudie la sensibilité à la lumière à l’intérieur de cet espace en appréciant la perception par le sujet examiné de tests lumineux d’intensité et de taille variables.
Il existe deux principales méthodes d’examen du champ visuel : la périmétrie cinétique et la périmétrie statique.
a Périmétrie cinétique
La périmétrie cinétique est réalisée à l’aide de l’appareil de Goldmann (fig. 1.50 et fig. 1.51). On projette sur une coupole un point lumineux de taille et d’intensité lumineuse données et on déplace ce point de la périphérie vers le centre jusqu’à ce qu’il soit perçu par le patient; cette manœuvre est répétée sur différents méridiens sur 360°.

A, B. Le patient fixe le point central de la coupole de Goldmann, tandis que l’examinateur projette un test lumineux déplacé de la périphérie de la coupole vers le centre. Le patient dispose dans la main d’une « alarme » qu’il actionne dès qu’il aperçoit le test lumineux dans son champ visuel.
Cet examen photographié met en évidence une évaluation du champ visuel réalisée à l’aide d’un périmètre cinétique. Sur la première partie de ce cliché de type clinique, on observe une patiente installée face à une grande coupole blanche, fixant un point noir central tout en tenant un bouton permettant d’indiquer la perception de stimuli lumineux périphériques. L’appareil, volumineux et courbé, est typique des dispositifs de périmétrie utilisés pour mesurer les limites de la vision périphérique. Sur la deuxième vue, prise sous un autre angle, une professionnelle de santé en blouse blanche effectue le réglage du périmètre, confirmant le cadre d’un examen ophtalmologique en consultation. La patiente garde le front appuyé sur la bande de maintien frontale, assurant stabilité et précision de l’évaluation visuelle. La scène est bien éclairée, dans un environnement clinique typique, mettant en valeur la posture méthodique adoptée pour ce type de test fonctionnel. Ces vues illustrent clairement le processus et l’interaction entre le patient et l’appareil, sans qu’aucun détail ne soit laissé au hasard.

A, B. L’examinateur trace un relevé graphique des réponses du patient.
Ce visuel présente deux vues d’un examen de champ visuel réalisé en périmétrie cinétique. Sur la première image (A), on observe un écran circulaire quadrillé fixé à un appareil optique, servant à cartographier le champ de vision du patient. Une tige métallique mobile et graduée est positionnée au centre de l’écran, indiquant le mouvement d’un stimulus lumineux pendant l’examen. L’image B met en scène le moment de l’examen, où une orthoptiste est installée face à l’appareil, concentrée sur la lecture et l’interprétation du test pendant que la patiente est assise derrière l’appareil, le menton et le front bien en appui contre les supports prévus pour stabiliser la tête. Cette configuration montre que l’orthoptiste guide le test en dessinant les résultats sur la feuille fixée à l'appareil tout en interrogeant la perception du sujet examiné. Ce type de cliché illustre une scène d’examen clinique de la fonction visuelle.
En répétant cet examen avec des tests de taille et d’intensité lumineuse décroissantes, on peut ainsi tracer des lignes grossièrement concentriques, ou isoptères, correspondant à des zones de sensibilité lumineuse différente.
L’examen est réalisé pour chacun des deux yeux séparément, avec la correction optique adaptée.
31L’examen du champ visuel normal permet ainsi d’obtenir deux tracés symétriques pour l’œil droit et l’œil gauche (fig. 1.52), formés suivant la réalisation de l’examen de trois ou quatre isoptères concentriques. Les limites du champ visuel ne sont pas strictement circulaires : elles présentent un aplatissement dans le secteur supérieur, correspondant au relief de l’arcade sourcilière, et une encoche nasale inférieure, correspondant au relief du nez.

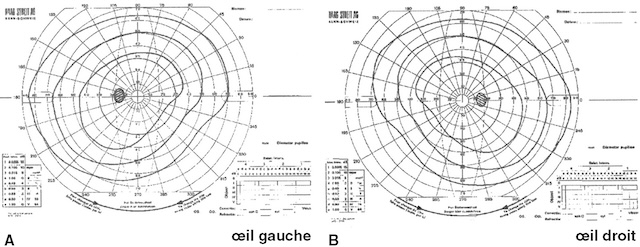
Ces deux tracés de périmétrie cinétique illustrent des champs visuels normaux pour les deux yeux. Sur le schéma A, correspondant à l’œil gauche, comme sur le schéma B, pour l’œil droit, les courbes isopérimétriques sont régulières et symétriques, centrées autour du point de fixation. Les cercles concentriques montrent une sensibilité uniforme dans toutes les directions, sans scotome ni altération périphérique détectable. L’aire centrale apparaît bien définie, et la répartition des seuils de détection est homogène, confirmant une intégrité fonctionnelle des voies visuelles. L’ensemble du tracé reflète un fonctionnement rétinien et neurologique équilibré, sans anomalie topographique suggestive de pathologie optique ou neurologique.
Au sein de ce tracé, on retrouve une zone aveugle correspondant à la papille (tache aveugle). L’examen du champ visuel cinétique est adapté à l’exploration des déficits des voies optiques en neuro-ophtalmologie.
b Périmétrie statique (fig. 1.53 et fig. 1.54)
Dans cette méthode, on présente un test lumineux fixe, dont on augmente l’intensité jusqu’à ce qu’il soit perçu par le sujet.

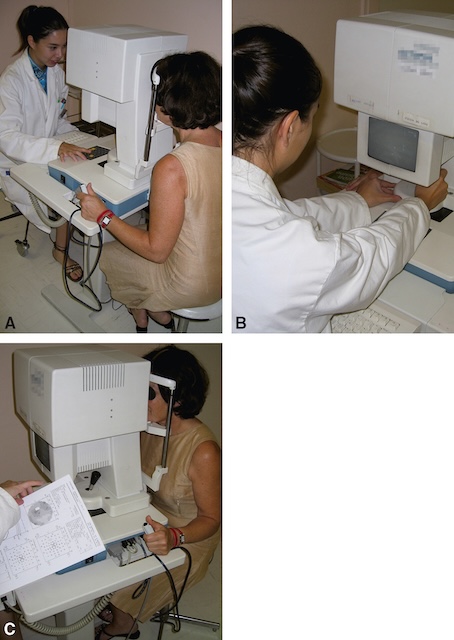
Le test lumineux est ici présenté au patient de façon automatique par l’appareil. Il s’agit, contrairement à la méthode précédente, d’un test fixe mais d’intensité lumineuse croissante.
Ces photographies montrent différentes étapes d’un examen du champ visuel réalisé avec un appareil de périmétrie statique automatisée. Sur la première, une patiente est assise face à la machine, le menton posé sur un appui spécifique pour assurer une position stable. La deuxième montre la professionnelle ajustant l'appareil, vérifiant les paramètres avant le début du test. Sur la dernière, l’examen est en cours : la patiente fixe un point lumineux tandis que l’autre œil est couvert ; la spécialiste tient une feuille de résultats imprimée qui reflète la sensibilité visuelle dans plusieurs zones du champ. Ce type d'examen permet de mesurer la perception périphérique et centrale, utilisé notamment dans le suivi du glaucome ou des atteintes neurologiques. L’ensemble des scènes exprime une interaction concrète entre patiente, soignante et appareil, dans un cadre clinique structuré.

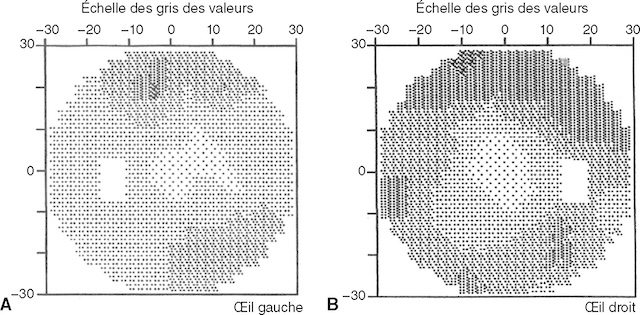
Ce double relevé de périmétrie statique, obtenu par un examen automatisé, illustre la sensibilité du champ visuel central sur 30 degrés pour l’œil gauche (A) et l’œil droit (B). Chaque carré de la grille représente un point de stimulation où la réponse du patient est enregistrée. Sur ces relevés, les zones plus sombres indiquent des endroits où la perception lumineuse est réduite voire absente. Pour l’œil gauche, une perte de sensibilité marquée est visible dans le quadrant inférieur nasal, tandis que l’œil droit présente un déficit similaire dans le quadrant supérieur temporal. L’ensemble du tracé met en évidence une atteinte symétrique du champ visuel, ce qui peut orienter vers une origine rétino-chiasmatique. Ces cartes sont couramment utilisées en consultation pour surveiller l’évolution de pathologies comme le glaucome ou certaines atteintes neurologiques.
3233C’est une méthode d’examen plus précise, qui explore de façon fine le champ visuel central. Elle est ainsi particulièrement indiquée dans la pathologie du nerf optique et au cours du glaucome : c’est la méthode de choix dans le dépistage et la surveillance du glaucome primitif.
De plus en plus couramment à l’heure actuelle, l’examen du champ visuel est réalisé à l’aide d’appareils automatisés.
2 Vision des couleurs
En pratique, il est utile d’effectuer un bilan de la vision des couleurs à la recherche d’une dys-chromatopsie dans deux circonstances :
- • pour dépister une anomalie congénitale, comme le daltonisme. On utilise alors des planches colorées (tables pseudo-isochromatiques dont la plus connue est celle d’Ishihara, fig. 1.55A et fig. 1.56) dont le motif et le fond, constitués de couleurs complémentaires, sont indiscernables pour un sujet atteint de dyschromatopsie congénitale. Ainsi, un sujet daltonien ne verra pas les dessins de planches dont le motif et le fond sont constitués de vert et de rouge;


Fig. 1.55 Examen de la vision chromatique.
A. Planches d’Ishihara : dépistage des dyscromatopsies congénitales d’axe rouge vert. B. Test de Farnsworth 100 Hue : on demande au patient de classer quatre plumiers de pastilles de différentes tonalités, de la plus claire à la plus foncée.Un homme est assis à une table dans un cadre clinique, concentré sur l’évaluation de sa vision des couleurs. Sur la première scène, il lit attentivement un livret de planches d’Ishihara, bien éclairé par une lampe de bureau dirigée vers les pages, ce qui permet une lecture précise des motifs colorés. Dans la seconde partie, il est engagé dans un test de Farnsworth, manipulant des pastilles colorées soigneusement disposées dans des bacs compartimentés. Chaque geste indique un processus rigoureux d’identification et de classement des teintes, reflétant une méthode d’examen visuel soignée utilisée pour tester la perception fine des nuances. L’ensemble de la scène montre un contexte professionnel, calme et ordonné, typique d’un environnement ophtalmologique.

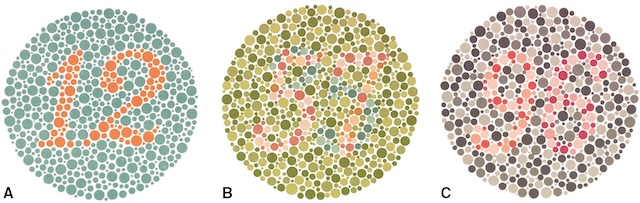
Fig. 1.56 Le test d’Ishihara permet de dépister des dyschromatopsies héréditaires d’axe rouge/vert.
A. Planche test lue par tous les sujets daltoniens. B. Planche lue avec erreurs par les sujets daltoniens. C. Planche permettant de différencier les sujets « deutan » et « protan ».Sur ces deux illustrations de planches colorées, on observe un cercle rempli de petits points de tailles variées. Dans la première, certains points rouges se détachent nettement sur un fond de tons verts, formant de manière évidente le chiffre 12. Ce contraste fort permet une lecture immédiate pour un observateur avec une vision des couleurs intacte. Dans la seconde illustration, ce chiffre n’est plus visible : les points sont tous dans des nuances grises, très proches les unes des autres, rendant la figure complètement indiscernable. Ce changement visuel reflète la manière dont une personne ayant un trouble de la perception des couleurs pourrait voir la même scène, sans parvenir à distinguer le motif qui était pourtant très clair dans la version précédente. Ce type de test sert à comparer la vision colorée normale avec une altération typique du spectre visuel.
- • en présence d’une affection oculaire acquise, on utilise habituellement le test de Farnsworth (fig. 1.55B) où l’on demande au patient de classer des pastilles colorées; les dyschromatop-sies acquises se traduisent habituellement par une vision altérée et une confusion de deux couleurs complémentaires : bleu et jaune (dans certaines affections rétiniennes) ou rouge et vert (au cours des neuropathies optiques).
L’étude de la vision des couleurs est ainsi une aide au diagnostic de certaines affections rétiniennes et des neuropathies optiques. Elle est aussi un élément essentiel de la surveillance des traitements susceptibles de provoquer une rétinopathie (antipaludéens de synthèse) ou une neuropathie optique médicamenteuse (principalement antituberculeux : éthambutol et isoniazide).
B 34Angiographie du fond d’œil (fig. 1.57)
C’est la prise de clichés du fond d’œil après injection intraveineuse d’un colorant fluorescent qui est, suivant les indications, soit de la fluorescéine, soit du vert d’indocyanine. Examen de réalisation simple, il ne présente que peu d’effets secondaires et de complications et peut être pratiqué chez la femme enceinte. Il existe cependant un risque très faible mais réel de choc anaphylactique.

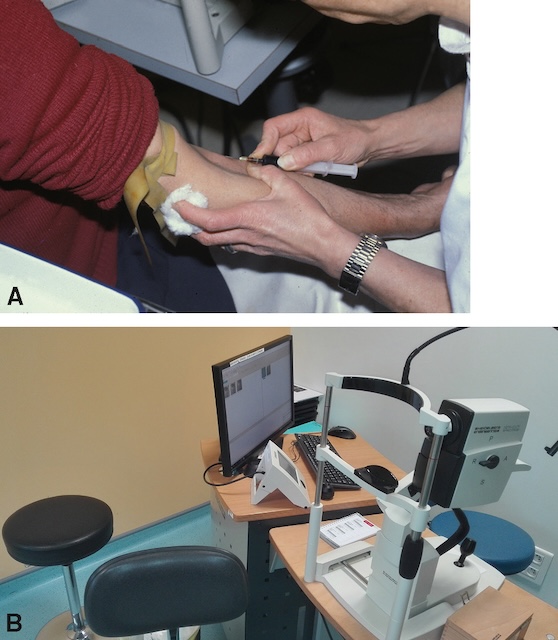
A. Injection du colorant par une veine périphérique. B. Prise de clichés à l’aide d’un « rétinographe ».
Cette série illustre une procédure d’angiographie du fond d’œil. Sur la première photographie, un professionnel de santé effectue une injection intraveineuse d’un colorant fluorescent au niveau de l’avant-bras du patient, à l’aide d’un garrot et d’un coton pour assurer un geste précis et sécurisé, marquant ainsi le début de l’examen. La deuxième image présente l’équipement utilisé pour capturer les images du fond d’œil : une caméra non mydriatique placée devant un poste informatique, avec appuie-menton et repose-front garantissant une bonne stabilité de la tête du patient. L’ensemble de cette séquence permet de visualiser la circulation du produit dans les vaisseaux rétiniens afin d’analyser l’état vasculaire rétinien de manière détaillée.
1 Angiographie fluorescéinique
Après injection de fluorescéine, des clichés photographiques en série à l’aide d’un filtre bleu permettront d’en visualiser le passage dans les vaisseaux rétiniens artériels puis veineux 35(fig. 1.58). L’angiographie fluorescéinique réalise ainsi une étude dynamique de la vascularisa-tion rétinienne.

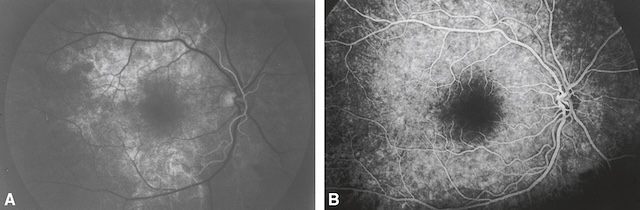
Sur le premier cliché (A), on observe une vue de fond d’œil capturée lors d’une angiographie fluorescéinique, illustrant la phase initiale du remplissage artériel. Les artères rétiniennes, bien dessinées, laissent apparaître les premiers passages du produit de contraste fluorescent. Le réseau vasculaire se détache progressivement sur un fond sombre, annonçant la dynamique circulatoire. Sur le second cliché (B), la phase veineuse de cette même angiographie est mise en évidence. Les veines rétiniennes, désormais bien remplies, tracent un motif plus large et contrasté que celui des artères. L’ensemble forme un schéma complet de la perfusion rétinienne, permettant d’examiner finement la continuité des vaisseaux et d’éventuelles anomalies. Ce type de photographie est utilisé dans les bilans visuels pour analyser les troubles vasculaires de la rétine sans recourir à une reconstruction numérique ou magnétique.
2 Angiographie au vert d’indocyanine
L’injection de vert d’indocyanine permet essentiellement de visualiser des vaisseaux choroï-diens pathologiques (vascularisation d’un angiome de la choroïde, mais surtout néovaisseaux choroïdiens au cours de la DMLA, fig. 1.59) et d’évaluer une atteinte choroïdienne inflammatoire (choroïdite).

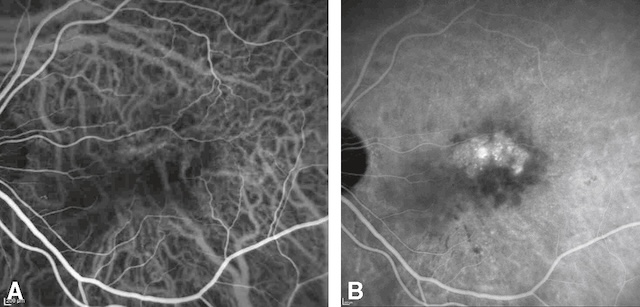
Sur cette angiographie réalisée avec un colorant à la vert d’indocyanine, deux vues du fond d’œil gauche sont mises en évidence. La première montre la densité complexe du réseau vasculaire choroïdien, avec des vaisseaux bien contrastés serpentant en profondeur autour de la région maculaire, ce qui reflète la phase précoce de l’examen. Sur la seconde image, l’attention est portée sur une large zone centrale hypercyanescente, à la limite irrégulière et à l’intensité inhomogène, signalant la présence de néovaisseaux choroïdiens occultes. Ces modifications sont typiques d’une forme humide de dégénérescence maculaire liée à l’âge (DMLA), et sont caractéristiques d’une diffusion tardive du colorant dans les structures pathologiques. L’ensemble de l’examen permet une exploration précise de l’anatomie choroïdienne en contexte pathologique.
C Explorations électrophysiologiques
L’électrorétinogramme (ERG) est l’enregistrement du potentiel d’action rétinien secondaire à une stimulation lumineuse de la rétine à l’aide d’une électrode cornéenne. L’ERG traduit une réponse globale de la rétine et n’est altéré qu’en cas de lésions rétiniennes étendues (fig. 1.60); ainsi, une atteinte maculaire responsable d’une baisse d’acuité visuelle sévère peut s’accompagner d’un ERG normal. L’ERG multifocal permet d’identifier une atteinte maculaire. Il s’agit d’un examen très utile au diagnostic de dystrophies rétiniennes héréditaires.

A. ERG normal. B. ERG « plat » : absence complète de réponse rétinienne témoin d’une atteinte rétinienne diffuse.
Le document montre deux tracés électrorétinographiques réalisés dans un cadre clinique. Sur le premier graphique (image A), des ondes bien formées apparaissent à la suite d'une stimulation lumineuse, identifiables grâce à deux pics marqués par les points A1 et B1, relevés à des intervalles précis en millisecondes. Le tracé du haut correspond à l’œil droit (OD), celui du bas à l’œil gauche (OG), et les deux présentent une amplitude notable mesurée en microvolts. Ces réponses électriques évoquent une activité rétinienne préservée. Sur le second graphique (image B), les tracés sont plats, avec une réponse quasi absente sur les deux yeux, ce qui peut être interprété comme un dysfonctionnement rétinien important. Les mesures détaillées sur les tableaux latéraux confirment les faibles amplitudes, avec une latence très faible voire absente. Les deux documents semblent extraits d’un test de type électrorétinogramme, probablement effectué dans un service ophtalmologique pour comparer la fonction rétinienne entre un œil sain et un œil pathologique.
2 36Potentiels évoqués visuels (fig. 1.61)
Les potentiels évoqués visuels (PEV) représentent les potentiels d’action naissant au niveau du cortex occipital à la suite d’une stimulation lumineuse de la rétine; ils explorent donc les voies optiques dans leur globalité, de la cellule ganglionnaire au cortex occipital. Ils sont un apport au diagnostic des neuropathies optiques et sont particulièrement intéressants dans la sclérose en plaques au cours de laquelle ils peuvent en effet être altérés en dehors de toute neuropathie optique cliniquement décelable.

Ce graphique issu d’un examen neuro-ophtalmologique montre les enregistrements des réponses visuelles à une stimulation lumineuse chez un patient, observées depuis deux régions cérébrales. Les deux tracés, notés pour les lobes droit et gauche, présentent des courbes ondulées, avec des pics marqués par des flèches et étiquetés N75, P100 et N135, correspondant aux différentes étapes de réponse du système visuel. Sur l’axe horizontal, le temps est mesuré en millisecondes, tandis que l’axe vertical indique la réponse électrique en microvolts. À droite, deux tableaux précisent les valeurs relevées, telles que l’amplitude et le moment d’apparition de chaque onde, ce qui permet de comparer les réactions de chaque hémisphère cérébral. L'ensemble de ces informations donne un aperçu précis de la manière dont le signal visuel est capté et traité à travers les voies nerveuses vers le cerveau.
D 37Echographie
Cet examen peut se faire selon deux modes différents :
- • en mode A (fig. 1.62), dont le principal intérêt est d’apprécier la longueur du globe oculaire (en particulier pour déterminer la puissance de l’implant lors de chirurgie de la cataracte chez les patients ayant une cataracte très dense);

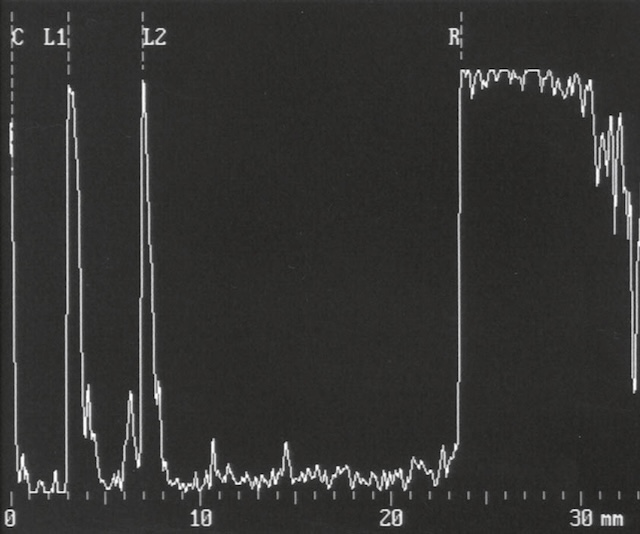
Fig. 1.62 Échographie A (biométrie oculaire). La longueur axiale normale est de 21 mm; ici, œil myope avec une longueur axiale entre 23 et 24 mm. C : cornée; L1 et L2 : faces (« capsules ») antérieure et postérieure du cristallin; R : rétine. Cette échographie A, utilisée en biométrie oculaire, montre les différentes interfaces internes de l’œil mesurées le long de l’axe visuel. On distingue nettement plusieurs pics correspondant aux structures traversées par l’onde ultrasonore : le premier pic noté C représente la cornée, suivi des pics L1 et L2 correspondant respectivement aux faces antérieure et postérieure du cristallin. Un pic plus large apparaît entre 23 et 24 mm, indiquant la rétine (notée R). La distance mesurée entre la cornée et la rétine révèle une longueur axiale supérieure à la normale, qui est de 21 mm, ce qui traduit ici un œil myope. Cette échographie permet donc de caractériser précisément la longueur de l’œil et joue un rôle fondamental dans l’évaluation des troubles de la réfraction et la préparation à une chirurgie oculaire.
- • en mode B (fig. 1.63), dont l’indication essentielle est de dépister un éventuel décollement de la rétine lors de trouble des milieux oculaires (cataracte ou hémorragie du vitré), ou encore pour localiser un corps étranger intraoculaire ou bien aider au diagnostic d’une tumeur intraoculaire ou intraorbitaire.

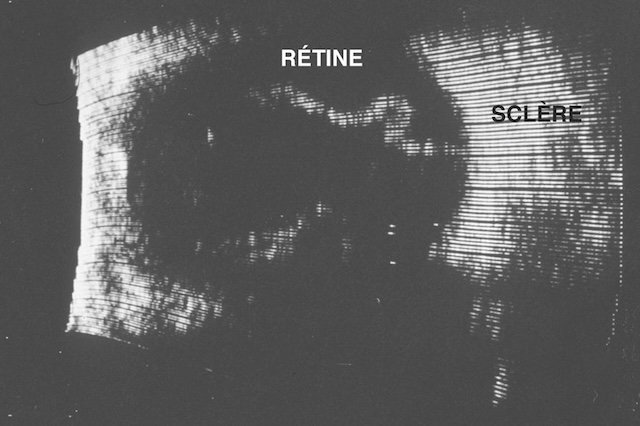
Fig. 1.63 Échographie B d’un œil porteur d’un décollement de rétine. L’image présente une échographie B réalisée sur un œil atteint d’un décollement de rétine. On distingue clairement les deux structures principales : la sclère en arrière-plan, dense et hyperéchogène, et la rétine, qui apparaît comme une membrane en relief, décollée et flottante dans l’espace vitréen. L’écho de la rétine montre une structure en arc ou en vague, typique d’un décollement, séparée de la paroi postérieure. Ce type d’imagerie permet d’examiner l’état du segment postérieur de l’œil lorsqu’un examen direct est difficile, notamment en cas de milieux opaques, comme une hémorragie vitréenne. Le tracé échographique met en évidence la topographie de la lésion, indispensable pour confirmer le diagnostic et orienter l’intervention.
E Tomographie en cohérence optique (optical cohérence tomography [OCT]) (fig. 1.64)
Il s’agit d’une méthode d’examen non invasive qui permet d’obtenir des « coupes » de la rétine, de la cornée et de l’angle iridocornéen d’une précision nettement supérieure à celle de l’échographie. L’OCT-angiographie permet de visualiser la vascularisation perméable active.

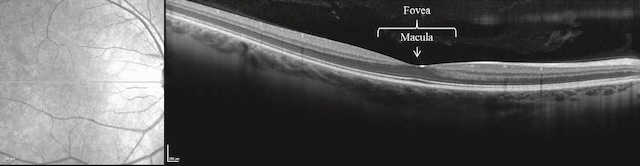
Cette coupe transversale obtenue par tomographie en cohérence optique (OCT) montre une rétine parfaitement structurée avec des limites nettes entre les différentes couches rétiniennes. À droite de l’image, on distingue la fovéa, creux central de la macula, qui apparaît comme une légère dépression symétrique. La macula, région centrale de la rétine responsable de la vision fine, présente un aspect régulier, sans soulèvement ni signe d’œdème. L’épaisseur rétinienne est uniforme, et aucune anomalie morphologique n’est visible, ce qui confirme l’intégrité de la structure rétinienne dans cette vue. À gauche, la représentation en fond d’œil en niveaux de gris permet de situer avec précision la zone d’analyse, en centrant le faisceau de balayage sur la macula. L’image est d’excellente qualité, sans artefacts, et correspond à un OCT de rétine sain chez un patient sans pathologie visible à ce niveau.
38Elle permet l’étude des affections maculaires :
- • confirmation du diagnostic d’une membrane prémaculaire ou d’un trou maculaire (fig. 1.65 et fig. 1.66);

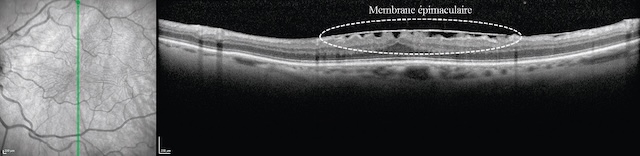
Fig. 1.65 OCT d’une membrane épirétinienne ou épimaculaire. Cette image correspond à une coupe transversale de la rétine obtenue par tomographie en cohérence optique (OCT), une technique d’imagerie médicale de haute résolution utilisée en ophtalmologie. À gauche, un fond rétinien en vue en surface montre le trajet des vaisseaux, avec une ligne verte indiquant l’axe de la coupe. À droite, la coupe transversale montre clairement une membrane épirétinienne située au-dessus de la macula, identifiée par une zone hyperréflective soulignant un décollement et des ondulations de la surface rétinienne. On distingue un bombement et un aspect plissé de la rétine interne, traduisant une traction exercée par cette membrane fibrocellulaire. L’architecture des couches rétiniennes en profondeur reste relativement bien conservée, bien que perturbée en surface. L’ensemble de cette coupe illustre les altérations morphologiques induites par une membrane épimaculaire, souvent associée à une baisse de l’acuité visuelle centrale et une distorsion des images perçues par le patient.

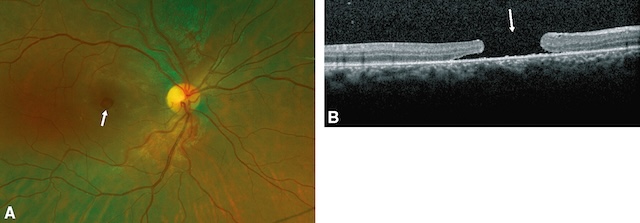
Fig. 1.66 Trou maculaire (flèches) vu sur une rétinophotographie du fond d’œil (A) et sur une coupe d’OCT rétinien centrée sur la macula (B). L’image A, une photographie du fond d’œil en couleur, montre clairement la macula légèrement pigmentée au centre, avec un petit point foncé marqué par une flèche blanche indiquant la présence d’un trou maculaire. Le disque optique apparaît bien défini avec un réseau de vaisseaux rétiniens rayonnant autour. Sur l’image B, une coupe réalisée par OCT (tomographie en cohérence optique) centrée sur la macula révèle une interruption nette des couches internes de la rétine, visible sous forme d’un vide vertical. Ce creux correspond précisément au trou observé dans l’image A. Le contraste entre les couches rétiniennes autour du trou et l’absence de tissu en son centre permet de bien apprécier l’étendue de l’atteinte.
- • quantification d’un œdème rétinien maculaire (par exemple dans le cadre de la DMLA, du diabète, des occlusions veineuses) et évolution sous traitement par la mesure de l’épaisseur maculaire (fig. 1.67);

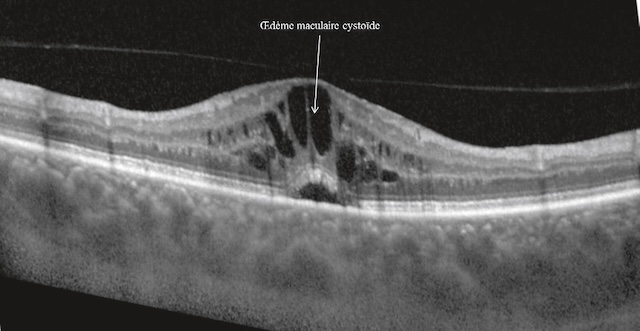
Fig. 1.67 OCT d’un œdème maculaire cystoïde. Ce cliché correspond à une coupe transversale de la rétine obtenue par imagerie OCT (tomographie par cohérence optique), centrée sur la région maculaire. On y observe de multiples logettes hypo-réflectives en forme de cavités arrondies au sein de l’épaisseur rétinienne, localisées principalement dans les couches internes et externes de la macula. Ces espaces bien délimités remplis de fluide sont typiques d’un œdème maculaire cystoïde. La flèche annotée au centre du document pointe précisément vers cette zone, confirmant la distension tissulaire secondaire à une accumulation de liquide. L’architecture rétinienne est globalement conservée, bien que soulevée par les cavités de l’œdème, ce qui traduit un processus inflammatoire ou post-chirurgical fréquent.
- • visualisation et localisation de néovaisseaux choroïdiens dans la DMLA.
39Elle est également utilisée dans le dépistage et le suivi du glaucome chronique car elle permet de mettre en évidence la perte de fibres optiques, premier signe du glaucome (fig. 1.68 et fig. 1.69).

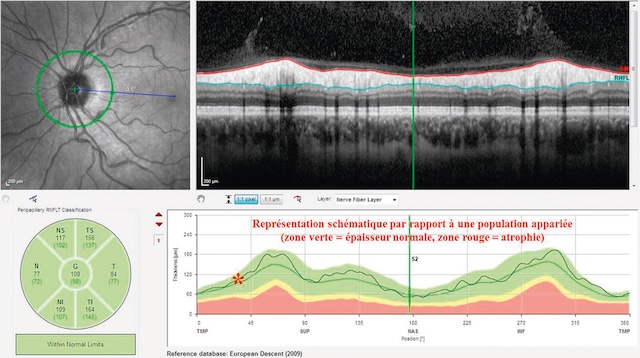
L’épaisseur des fibres nerveuses rétiniennes du patient (RNFL ou retinal nerve fiber layer ; astérisque sur la figure) est située dans la zone normale (verte) pour une population appariée.
Ce visuel correspond à un examen d’imagerie OCT papillaire (Tomographie par Cohérence Optique), utilisé pour analyser la tête du nerf optique et la couche de fibres nerveuses rétiniennes. En haut à gauche, une image en coupe du fond d’œil montre un cercle vert délimitant la région péripapillaire, à partir de laquelle les données sont acquises. L’image en coupe transversale à droite révèle les différentes couches rétiniennes, avec la couche des fibres nerveuses (RNFL) bien visible et d’épaisseur uniforme, marquée par une ligne rouge. En bas, le graphique compare l’épaisseur mesurée à une base de données de référence : la courbe verte représentant les valeurs individuelles suit globalement la zone verte normale, tandis que la zone rouge désigne une atrophie. Aucun signe d'amincissement pathologique n'est visible, ce qui confirme une structure papillaire conservée.

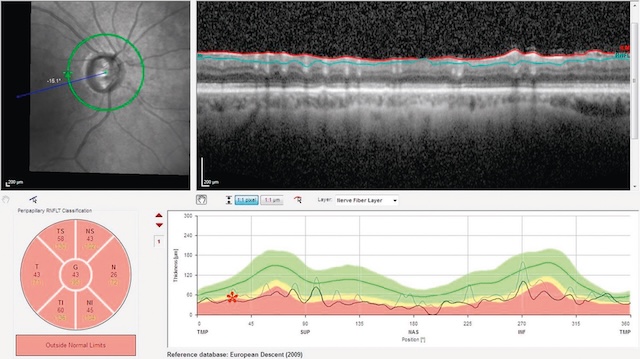
La courbe du patient (noire) est située dans la zone atrophique (rouge).
Cette image de tomographie en cohérence optique montre une analyse papillaire centrée sur la tête du nerf optique, combinée à une cartographie de l’épaisseur des fibres nerveuses rétiniennes péripapillaires. En haut à gauche, le cliché de fond d’œil indique la zone scannée par un cercle vert, positionné autour de la papille optique. À droite, la coupe transversale en niveaux de gris révèle une excavation marquée au centre de la papille, avec une courbe de surface nettement déprimée. La ligne rouge superposée à la couche des fibres nerveuses indique une diminution significative de leur épaisseur. En bas, le graphique de distribution des fibres présente des segments largement sous la norme, notamment dans les quadrants temporaux et inférieurs, représentés dans la zone rouge, signalant une perte majeure de fibres. Le cadran de classification montre des valeurs globalement altérées (G=43, TS=56, T=43), confirmant une atteinte sévère du nerf optique, possiblement d’origine glaucomateuse.
40Elle quantifie l’ouverture de l’angle iridocornéen.
Enfin, elle permet d’analyser finement les différentes couches de la cornée, en fournissant des coupes sagittales et des cartes de forme et d’épaisseur.
Les indications de l’OCT se sont multipliées au cours des dernières années.
F Examen du segment antérieur
1 Topographie et tomographie cornéenne
La topographie cornéenne permet de recueillir des informations relatives à la courbure ou au relief (élévation) de la cornée, grâce à la projection et l’analyse du reflet d’un motif lumineux éclairant ou balayant la cornée. La tomographie cornéenne permet d’analyser l’épaisseur de la cornée en explorant ses faces antérieures et postérieures. Les images recueillies sont analysées sous forme de cartes en couleur. Elles sont prescrites pour l’analyse de l’astigmatisme, notamment à la recherche d’un kératocône ou des œdèmes cor-néens (fig. 1.70 à fig. 1.72).

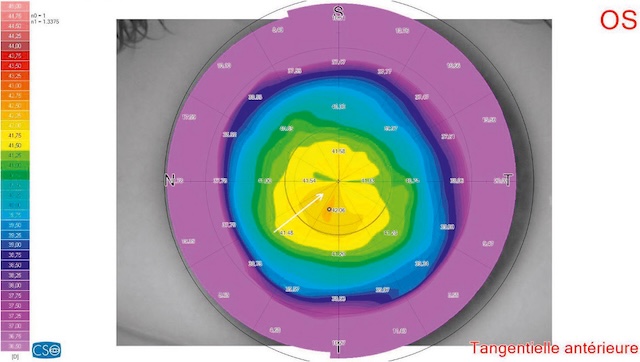
Cette image représente une carte de topographie cornéenne centrée sur l’œil gauche. Elle montre clairement une configuration régulière en forme de sablier, caractéristique d’un astigmatisme symétrique. Les zones de couleur jaune et verte, situées au centre de la cornée, suggèrent une courbure plus accentuée, tandis que les teintes bleues et violettes en périphérie traduisent un aplatissement progressif. L’ensemble du tracé est cohérent, sans irrégularité marquée, ce qui confirme la nature régulière de l’astigmatisme. Ce genre de mesure est souvent utilisé avant une chirurgie réfractive ou dans le suivi de pathologies cornéennes comme le kératocône, même si ici, l’aspect est compatible avec une cornée stable.

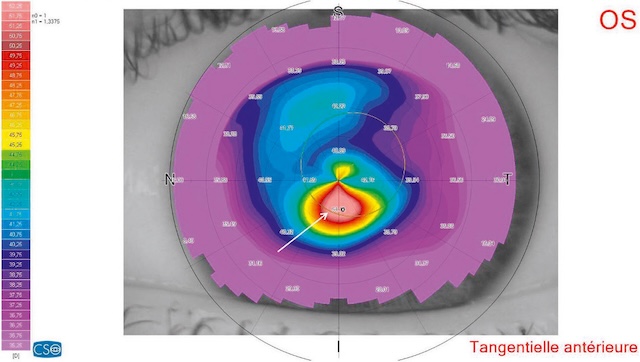
Ce cliché correspond à une topographie cornéenne tangentielle antérieure de l’œil gauche (OS), illustrant la courbure de la cornée à l’aide d’un code couleur précis. Les tons rouges et oranges au centre inférieur désignent une zone de courbure accentuée, traduisant une protrusion localisée de la cornée. Ce bombement est décentré vers l’inféro-nasal et contraste avec les zones périphériques en bleu et violet qui indiquent une courbure plus aplatie. L’aspect asymétrique et irrégulier de cette carte suggère un astigmatisme non régulier, typique d’un kératocône. La flèche blanche pointe la zone de courbure maximale, confirmant une déformation localisée et évolutive de la cornée, souvent responsable d’une baisse d’acuité visuelle progressive.


Sur cette photographie prise en situation clinique, on distingue un appareil de diagnostic ophtalmologique de type topographe cornéen, identifiable à ses cercles concentriques noirs et blancs parfaitement dessinés sur une large structure circulaire en plastique. Ce motif permet de projeter des mires sur la surface de la cornée, afin d’analyser précisément sa courbure. L’appareil repose sur une table et est maintenu par un support rigide avec montants verticaux. Un repose-menton blanc placé au centre permet au patient de positionner son visage avec précision, tandis qu’une barre horizontale sert de guide frontal. Un câble d’alimentation est relié à la base, confirmant qu’il s’agit d’un équipement actif prêt à l’utilisation. L’environnement de la salle est typique d’un cabinet d’ophtalmologie, avec du mobilier médical en arrière-plan et un éclairage sobre, favorable à la mesure précise de la surface cornéenne.
2 41OCT de segment antérieur
La tomographie en cohérence optique (OCT) permet de recueillir des informations relatives à l’anatomie et la transparence cornéenne, de la chambre antérieure, du limbe de l’angle irido-cornéen et du cristallin (fig. 1.73). Il est possible d’obtenir des flux peropératoires d’OCT via le microscope opératoire.

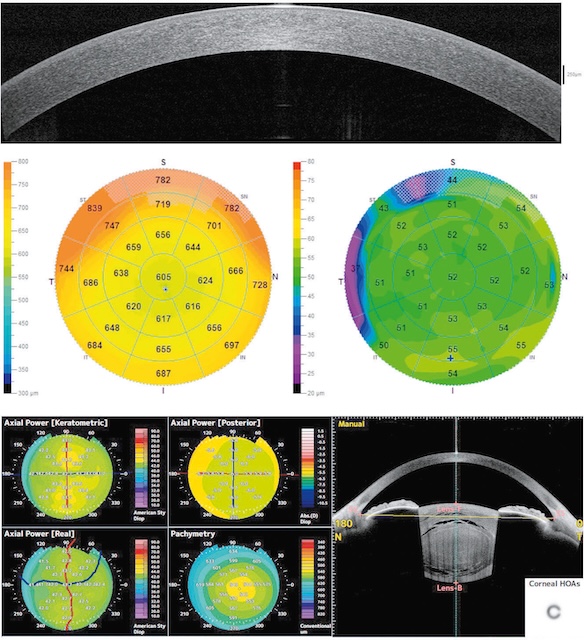
Coupe de cornée normale (A), deux cartes d’épaisseur épithéliale et stromale (B) et analyse du segment antérieur (C) avec quatre cartes d’analyse cornéenne et la coupe de segment antérieur visualisant l’axe central d’un cristallin présentant une cataracte.
Cette image représente une analyse complète du segment antérieur de l’œil à l’aide d’une OCT (Tomographie par Cohérence Optique). La vue supérieure montre une coupe transversale de la cornée en haute définition, mettant en évidence l’uniformité de son épaisseur. Au centre, les cartes topographiques et pachymétriques permettent d’évaluer la courbure cornéenne et la répartition de l’épaisseur à différents points, avec un centre cornéen relativement symétrique. Sur la gauche en bas, les cartes axiales mesurent la puissance optique antérieure et postérieure, tandis que la carte de pachymétrie montre des mesures régulières, sans amincissement significatif. À droite, une reconstruction en coupe frontale inclut aussi le cristallin, soulignant la position normale de l’iris et l’absence d’anomalie morphologique visible.
3 Biométrie
La biométrie consiste en la mesure couplée de la courbure de la cornée (ou kératométrie) et de la longueur antéropostérieure (axiale) de l’œil. La mesure est réalisée à l’aide d’un dispositif optique. Elle est utilisée pour le calcul de la puissance d’implant en chirurgie de la cataracte (fig. 1.74).

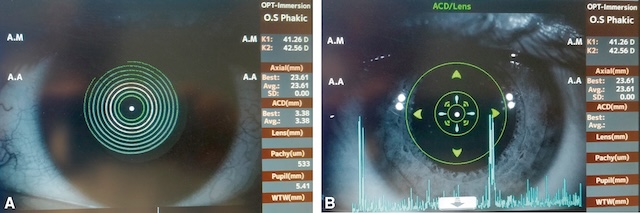
Elle associe l’évaluation de la kératométrie, par exemple sur une mesure topographique (A), et de la longueur antéropostérieure (axiale) de l’œil obtenue, par exemple sur mesure échographique (B). Une formule utilise les données biométriques pour le calcul de puissance de lentille intraoculaire. A. Kératométrie : mesure de la cambrure de la cornée. B. Mesure de la longueur axiale (distance entre l’apex de la cornée et la fovéa environ 22,5 mm).
Cette double capture représente une session de biométrie oculaire pour l’œil gauche (OS) dans le cadre d’une évaluation préopératoire, probablement avant une chirurgie de la cataracte. L’image A montre un affichage concentrique centré sur la cornée, illustrant les anneaux de réflexion utilisés pour analyser la topographie cornéenne. À droite, les données chiffrées fournissent les valeurs de kératométrie (K1 : 41,26 D ; K2 : 42,56 D), la longueur axiale (23,61 mm), la profondeur de la chambre antérieure (ACD : 3,38 mm), l’épaisseur cornéenne centrale (pachymétrie : 533 µm), le diamètre pupillaire (5,41 mm), ainsi que la distance blanc à blanc (WTW). L’image B, toujours centrée sur l’œil gauche, montre un alignement précis sur l’axe visuel, accompagné d’un pic sur le graphique en bas, représentant le signal de retour de l’interférométrie optique pour la mesure de la lentille. Ces examens permettent une évaluation biométrique complète, essentielle au calcul de l’implant intraoculaire personnalisé.
4243Au terme de l’examen clinique, le raisonnement ophtalmologique se fera sur le motif de consultation. Les deux motifs les plus fréquents sont la baisse de vision et l’œil rouge. L’algorithme de raisonnement face à ces deux symptômes est présenté dans la figure 1.75.

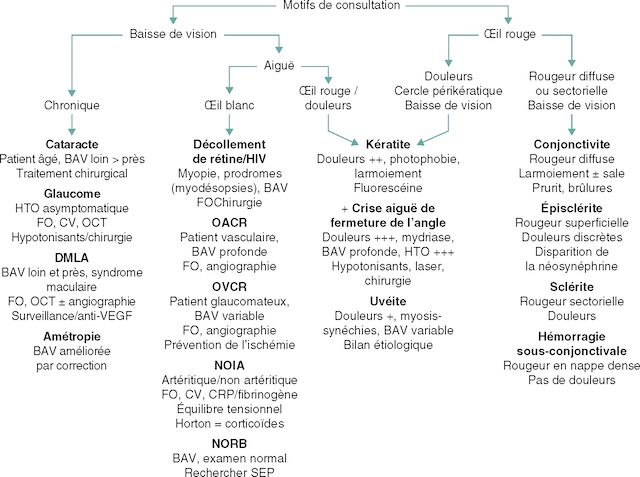
BAV : baisse d’acuité visuelle; CV : champ visuel; FO : fond d’œil; HIV : hémorragie intravitréenne; HTO : hypertonie oculaire; OACR : occlusion de l’artère centrale de la rétine; OCT : tomographie par cohérence optique; OVCR : occlusion de la veine centrale de la rétine; NOIA : neuropathie optique ischémique antérieure; NORB : névrite optique rétrobulbaire; SEP : sclérose en plaques; VEGF : vascular endothelial growth factor.
Ce schéma est un arbre décisionnel médical construit pour guider le raisonnement clinique face à une baisse de vision, qu’elle soit chronique ou aiguë, associée ou non à un œil rouge ou douloureux. À gauche, le tableau clinique d’une baisse de vision chronique oriente vers des pathologies comme la cataracte, le glaucome, la DMLA ou encore des amétropies, chacune avec ses caractéristiques, examens complémentaires et traitements. Au centre, en cas de baisse aiguë avec œil blanc, des urgences telles que le décollement de rétine, l’occlusion d’artère centrale ou de veine rétinienne, ou encore des neuropathies optiques (NOIA, NORB) sont envisagées. L’œil rouge douloureux mène à des diagnostics comme la kératite, une crise aiguë de fermeture de l’angle ou une uvéite, avec leurs signes cliniques typiques comme la photophobie, la mydriase ou les myosis avec synéchies. Enfin, à droite, un œil rouge sans douleur importante suggère des causes plus superficielles comme la conjonctivite, l’épisclérite ou l’hémorragie sous-conjonctivale, dont l’aspect est évocateur mais sans douleur marquée. Le tout forme une carte logique de tri pour une consultation ophtalmologique.
 46Compléments en ligne
46Compléments en ligne
Des compléments numériques sont associés à ce chapitre. Ils sont indiqués dans le texte par un picto. Pour voir ces compléments, connectez-vous sur http://www.em-consulte.com/ e-complements/478662 et suivez les instructions.


Photographie clinique en trois volets illustrant l’utilisation d’un réfracteur automatique pour les tests de vision à différentes distances. À gauche, un patient est installé face à l’appareil pour un test de vision de loin, identifié comme test Monoyer. L’appareil couvre ses yeux tandis qu’il regarde à travers les lentilles. L’image centrale montre l’équipement seul, orienté vers une cible placée à une distance marquée de 5 mètres. À droite, le même type d’appareil est utilisé pour le test de vision de près Parinaud : un patient tient une carte de lecture à une distance mesurée entre 33 et 40 centimètres. Les légendes intégrées à chaque photo indiquent clairement les types de vision testés et les distances correspondantes.

Cette photographie illustre une scène typique d’évaluation de la vision de loin, dans un cadre médical. Une patiente est assise, de dos, fixant un tableau d'acuité visuelle affiché sur un mur clair. Le tableau contient plusieurs lignes de lettres majuscules noires allant de la plus grande en haut à la plus petite en bas, ce qui permet de tester progressivement la capacité visuelle. À sa droite, un équipement ophtalmologique est installé, prêt à être utilisé pour d'autres examens. La patiente semble attentive, regard droit vers les lettres, indiquant une phase de lecture visuelle. Aucun détail inutile n’est présent, ce qui oriente l’attention sur l’essentiel : la position du corps, la distance au tableau et le contexte optique. Ce type de test est couramment utilisé pour évaluer l'acuité visuelle et orienter les besoins en correction optique.
