CHAPITRE 8: Item 82 Altération aiguë de la vision
Pr N. Bouheraoua, , DrA. Sellam and , DrA. Levy, Centre hospitalier national d’ophtalmologie des Quinze-Vingts, Paris
Situations cliniques de départ
Les anomalies de la vision d’apparition brutale peuvent être évoquées dans les situations cliniques suivantes.
 27 – Chute de la personne âgée : la vision apportant environ 80 % des informations sensorielles, une baisse de l’acuité visuelle ou une malvoyance peuvent être la cause de chute chez les personnes âgées présentant une altération brutale de l’acuité visuelle.
27 – Chute de la personne âgée : la vision apportant environ 80 % des informations sensorielles, une baisse de l’acuité visuelle ou une malvoyance peuvent être la cause de chute chez les personnes âgées présentant une altération brutale de l’acuité visuelle.
 42 – Hypertension artérielle : la NOIA non artéritique peut se voir dans un contexte d’HTA associée à des facteurs de risque cardiovasculaire. La rétinopathie hypertensive (associant œdème papillaire, nodules cotonneux péripapillaires, hémorragies rétiniennes, nodules cotonneux) entraîne une baisse d’acuité visuelle brutale.
42 – Hypertension artérielle : la NOIA non artéritique peut se voir dans un contexte d’HTA associée à des facteurs de risque cardiovasculaire. La rétinopathie hypertensive (associant œdème papillaire, nodules cotonneux péripapillaires, hémorragies rétiniennes, nodules cotonneux) entraîne une baisse d’acuité visuelle brutale.
 174 – Traumatisme facial : une hémorragie intravitréenne et un décollement de rétine peuvent faire suite à un traumatisme oculaire.
174 – Traumatisme facial : une hémorragie intravitréenne et un décollement de rétine peuvent faire suite à un traumatisme oculaire.
 178 – Demande/prescription raisonnée et choix d’un examen diagnostique : devant un tableau, toujours éliminer une cause artéritique (maladie de Horton). Il convient donc de réaliser une VS et une CRP.
178 – Demande/prescription raisonnée et choix d’un examen diagnostique : devant un tableau, toujours éliminer une cause artéritique (maladie de Horton). Il convient donc de réaliser une VS et une CRP.
 208 – Hyperglycémie : la rétinopathie diabétique est la première cause de cécité en France chez les personnes de moins de 65 ans. La maculopathie diabétique œdémateuse, l’hémorragie intravitréenne ainsi que le décollement de rétine tractionnel (dans le cadre d’une rétinopathie diabétique proliférante) peuvent entraîner une baisse d’acuité visuelle brutale.
208 – Hyperglycémie : la rétinopathie diabétique est la première cause de cécité en France chez les personnes de moins de 65 ans. La maculopathie diabétique œdémateuse, l’hémorragie intravitréenne ainsi que le décollement de rétine tractionnel (dans le cadre d’une rétinopathie diabétique proliférante) peuvent entraîner une baisse d’acuité visuelle brutale.
Hiérarchisation des connaissances
| Rang | Rubrique | Intitulé et descriptif |
|
|
Identifier une urgence | Conduite à tenir devant une baisse de vision brutale avec œil blanc et identification des urgences |
|
|
Identifier une urgence | Savoir évoquer un décollement de rétine : description sémiologique |
|
|
Définition | Connaître la définition, la signification, et la démarche étiologique devant une cécité monoculaire transitoire |
|
|
Diagnostic positif | Savoir interpréter un réflexe photomoteur direct et consensuel (objectif commun avec item 81) |
|
|
Diagnostic positif | Connaître les signes d’une crise de glaucome aigu par fermeture de l’angle |
|
|
Diagnostic positif | Savoir évoquer le diagnostic d’aura migraineuse : AIT, crise épileptique partielle |
|
|
Diagnostic positif | Connaître les modalités du diagnostic d’une céphalée aiguë |
|
|
Diagnostic positif | Connaître les signes cliniques d’une neuropathie optique (NOIA, NORB, œdème papillaire) |
|
|
Diagnostic positif | Connaître les diagnostics différentiels de l’aura migraineuse : AIT, crise épileptique partielle : décollement de rétine, glaucome, hémorragie du vitré |
|
|
Diagnostic positif | Connaître la présentation clinique, les modes de survenue, les facteurs de risque des décollements de rétine |
|
|
Diagnostic positif | Connaître les signes cliniques d’une hémorragie du vitré et ses principales causes : acuité visuelle, champ visuel, PEV, OCT |
|
|
Diagnostic positif | Connaître les signes cliniques des affections vasculaires de la rétine (OACR, OVCR), leurs complications (néovascularisation, glaucome néovasculaire, œdème maculaire) et les principes de traitement |
|
|
Étiologies | Connaître les principales causes de déficit neurologique récent transitoire |
|
|
Étiologies | Connaître les principales causes d’atteinte des voies optiques et du nerf optique et identifier les étiologies nécessitant une prise en charge urgente (NOIAA, œdème papillaire) |
|
|
Prise en charge | Connaître la prise en charge en urgence du glaucome aigu par fermeture de l’angle |
|
|
Prise en charge | Connaître la conduite à tenir devant un œil rouge douloureux avec baisse de l’acuité visuelle (BAV) |
|
|
Examens complémentaires | Connaître les principaux examens complémentaires en ophtalmologie et leurs indications : atteinte du segment antérieur, du nerf optique (objectif commun avec item 81), de la rétine (AV, angiographie, OCT maculaire, ERG) |
|
|
Examens complémentaires | Indications de l’imagerie devant un trouble visuel récent |
|
|
Contenu multimédia | Interpréter un réflexe photomoteur direct et consensuel (objectif commun avec item 81) |
|
|
Contenu multimédia | Photographie d’un champ visuel des deux yeux avec hémianopsie (quadranopsie) latérale homonyme (ou bitemporale), y compris déficit pupillaire afférent relatif |
I Diagnostic
![]() Le diagnostic repose sur l’interrogatoire, l’examen clinique et éventuellement des examens complémentaires, guidés par la clinique.
Le diagnostic repose sur l’interrogatoire, l’examen clinique et éventuellement des examens complémentaires, guidés par la clinique.
A Interrogatoire
- • le type de l’altération visuelle :
- – existe-t-il une baisse d’acuité visuelle ?
- – existe-t-il une altération du champ visuel (scotome, déficit périphérique) ?
- – le patient décrit-il une sensation de « mouches volantes » = myodésopsies ?
- – a-t-il vu des éclairs lumineux = phosphènes ?
- – a-t-il une vision déformée des objets = métamorphopsies ?
- • sa rapidité d’installation :
- • son uni- ou bilatéralité ;
- • la présence ou non de douleurs associées et leur type. S’agit-il :
- • les antécédents oculaires et généraux ;
- • les traitements oculaires et généraux suivis;
- • une notion de traumatisme, même minime.
B Examen ophtalmologique
L’examen comprend aux deux yeux :
- • la mesure de l‘acuité visuelle de loin et de près, avec correction optique si nécessaire;
- • la réactivité pupillaire : réflexe photomoteur direct et réflexe photomoteur consensuel à l’éclairement de l’œil controlatéral;
- • l‘examen du segment antérieur : cornée, chambre antérieure et cristallin;
- • la mesure du tonus oculaire;
- • l’examen du fond d’œil après dilatation pupillaire : nerf optique, vaisseaux rétiniens, rétine.
C 172Examens complémentaires
![]() Les examens complémentaires ne sont pas systématiques et sont orientés par l’interrogatoire et l’examen clinique :
Les examens complémentaires ne sont pas systématiques et sont orientés par l’interrogatoire et l’examen clinique :
- • examens complémentaires ophtalmologiques (voir chapitre 1);
- • examens complémentaires non ophtalmologiques : qu’il s’agisse d’examens biologiques ou d’examens radiologiques, ils sont guidés par les premières orientations diagnostiques.
Les principaux examens complémentaires disponibles pour orienter le diagnostic et la prise en charge en ophtalmologie sont :
- • les champs visuel de Goldman (périmétrie cinétique) ou périmétrie statique automatisée) : ils permettent d’explorer le champ visuel. Ils sont à réaliser en cas de glaucome, de pathologie neuro-ophtalmologique (neuropathie optique ischémique antérieure [NOIA], névrite optique rétrobulbaire [NORB], hypertension intracrânienne [HTIC], etc.), dans la surveillance des antipaludéens de synthèse ou en cas de baisse d’acuité visuelle inexpliquée;
- • la tomographie en cohérence optique (OCT) : permet d’obtenir une coupe de la rétine, centrée sur l’aire maculaire. Cet examen est indiqué en cas d’anomalie maculaire au fond d’œil (drusen, hémorragie, traction vitréomaculaire, trou maculaire, membrane épimacu-laire, etc.). Il est de plus en plus demandé dans le bilan préopératoire de la cataracte. L’OCT peut aussi être centré sur la tête du nerf optique et permet l’analyse des fibres nerveuses périrétiniennes (retinal nerve fiber layer [RNFL]) ou du complexe ganglionnaire. Cet examen est demandé en cas de glaucome ou de pathologie neuro-ophtalmologique;
- • la tomographie en cohérence optique-angiographie (OCT-A) : permet d’obtenir une image de la perfusion rétinienne, de visualiser des néovaisseaux prérétiniens, intrarétiniens ou choroïdiens sans injection de produit de contraste;
- • l’angiographie à la fluorescéine : permet de visualiser la perfusion de la vascularisation rétinienne. Cet examen est indiqué en cas de pathologie rétinienne (dégénérescence maculaire liée à l’âge [DMLA], diabète, occlusion de la veine centrale de la rétine [OVCR], occlusion de l’artère centrale de la rétine [OACR], etc.);
- • l’angiographie au vert d’indocyanine (ICG) : permet de visualiser les vaisseaux choroïdiens et la choriocapillaire. Elle est indiquée en cas de DMLA ou de pathologie inflammatoire (uvéite postérieure);
- • l’électrophysiologie visuelle (électrorétinogramme [ERG], électro-oculogramme [EOG], potentiels évoqués visuels [PEV]) : ces examens permettent d’évaluer la fonction des photorécepteurs et du nerf optique.
II Étiologie
![]() Au terme de ces examens, plusieurs cas de figure peuvent se présenter.
Au terme de ces examens, plusieurs cas de figure peuvent se présenter.
A Baisse d’acuité visuelle avec œil rouge et douloureux
Il s’agit d’une affection aiguë du segment antérieur (voir chapitre 6).
2 173Crise aiguë de fermeture de l’angle
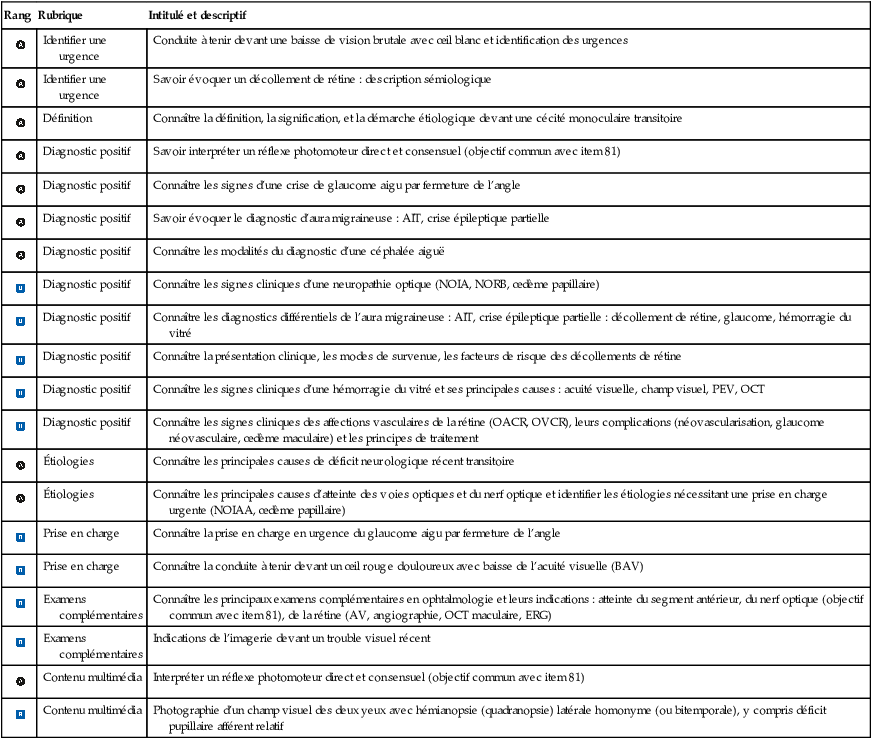
Très souvent appelée à tort glaucome aigu, la crise aiguë de fermeture de l’angle (CAFA) est symptomatique, avec douleurs oculaires profondes, intenses, oculaires et péri-oculaires, irradiant dans le territoire du trijumeau, et baisse de l’acuité visuelle aiguë. Sa prise en charge est une urgence ophtalmologique qui permet le plus souvent d’éviter des atteintes du nerf optique et donc un glaucome.
![]() Le risque de CAFA augmente avec l’âge, et est plus élevé chez les femmes et lorsque le globe oculaire est de petite taille (sujets hypermétropes).
Le risque de CAFA augmente avec l’âge, et est plus élevé chez les femmes et lorsque le globe oculaire est de petite taille (sujets hypermétropes).
Une dilatation pupillaire physiologique (obscurité, stress, exercice physique) ou pharmaco-logique (dilatation pupillaire pour un examen du fond d’œil, ou tous les agents pharmaco-logiques pouvant dilater la pupille, par exemple certains antihistaminiques, antidépresseurs, anxiolytiques, vasoconstricteurs, antiparkinsoniens, anticholinergiques, etc.) peuvent constituer l’élément déclenchant d’une CAFA.
![]() La symptomatologie est brutale et bruyante, avec des douleurs oculaires et une baisse d’acuité visuelle souvent profonde. Les douleurs oculaires peuvent s’accompagner de nausées et de vomissements. À l’examen macroscopique, l’œil est rouge, et la pupille souvent en semi-mydriase non réactive à la lumière. L’examen ophtalmologique met en évidence une acuité visuelle diminuée, une pression intraoculaire (PIO) élevée (plus de 30 mmHg), appréciable par la palpation bidigitale du globe oculaire à travers la paupière supérieure (sensation de bille de bois). On observe une hyperhémie conjonctivale avec un cercle périkératique, un œdème de cornée, une chambre antérieure peu profonde et en gonioscopie un angle irido-cornéen fermé (e-fig.8.1).
La symptomatologie est brutale et bruyante, avec des douleurs oculaires et une baisse d’acuité visuelle souvent profonde. Les douleurs oculaires peuvent s’accompagner de nausées et de vomissements. À l’examen macroscopique, l’œil est rouge, et la pupille souvent en semi-mydriase non réactive à la lumière. L’examen ophtalmologique met en évidence une acuité visuelle diminuée, une pression intraoculaire (PIO) élevée (plus de 30 mmHg), appréciable par la palpation bidigitale du globe oculaire à travers la paupière supérieure (sensation de bille de bois). On observe une hyperhémie conjonctivale avec un cercle périkératique, un œdème de cornée, une chambre antérieure peu profonde et en gonioscopie un angle irido-cornéen fermé (e-fig.8.1).
L’examen de l’œil adelphe montre généralement une chambre antérieure peu profonde et un angle iridocornéen étroit. La pupille de l’œil adelphe ne doit pas être dilatée pour l’examen.
Le traitement est une urgence, et nécessite souvent une hospitalisation. La PIO est réduite rapidement par l’administration de collyres réduisant la PIO (les quatre classes thérapeutiques disponibles peuvent être utilisées), combinée avec l’administration par voie générale d’agents entraînant une déshydratation du globe oculaire (acétazolamide [Diamox®] par voie IV ou orale, et mannitol par voie IV). Après cette prise en charge, un collyre myotique est utilisé de façon à ramener la pupille en myosis et à faciliter l’écoulement de l’humeur aqueuse de la chambre postérieure vers la chambre antérieure (pilocarpine collyre).
Une fois la PIO normalisée et l’œdème de cornée réduit, une iridotomie laser est réalisée de façon à éviter une récidive (fig. 8.2). Une iridotomie préventive de l’œil controlatéral est également réalisée de façon systématique.

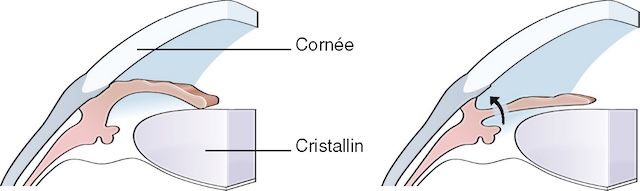
Source : © Carole Fumat.
Illustration médicale schématique en coupe sagittale de l’œil, composée de deux parties juxtaposées. À gauche, on observe un angle iridocornéen fermé dû à un bombement de l’iris vers l’avant, bloquant la circulation de l’humeur aqueuse entre la chambre postérieure et antérieure - c’est le tableau classique d’un blocage pupillaire. À droite, la même configuration anatomique est montrée après réalisation d’une iridotomie au laser : une petite ouverture est pratiquée à travers l’iris périphérique, permettant à l’humeur aqueuse de contourner la pupille et de rétablir un flux normal. Cette intervention supprime la pression excessive à l’origine du blocage, illustrant ainsi un traitement efficace dans le glaucome à angle fermé.
Parfois, le traitement médical n’est pas suffisant ou efficace, et une prise en charge chirurgicale (trabéculectomie et/ou chirurgie de la cataracte) doit être envisagée.
![]() Lorsqu’une iridotomie ou une chirurgie de la cataracte a été réalisée, le risque de fermeture de l’angle lors d’une dilatation pupillaire disparaît, et les agents pharmacologiques mydria-tiques ne sont plus contre-indiqués.
Lorsqu’une iridotomie ou une chirurgie de la cataracte a été réalisée, le risque de fermeture de l’angle lors d’une dilatation pupillaire disparaît, et les agents pharmacologiques mydria-tiques ne sont plus contre-indiqués.
3 174Uvéites
a Uvéite antérieure aiguë (iridocyclite)
L’examen à la lampe à fente met en évidence la présence de cellules inflammatoires dans la chambre antérieure (phénomène de Tyndall), avec éventuellement précipités rétrocornéens et synéchies iridocristalliniennes.
L’examen du fond d’œil après dilatation pupillaire recherche des signes d’uvéite postérieure associés.
b Uvéite postérieure (« choroïdite », « rétinite »)
La cause la plus fréquente des choroïdites est la toxoplasmose oculaire.
Elle est responsable d’une rétinochoroïdite récidivante, qui peut s’accompagner de signes inflammatoires vitréens. En cas d’uvéite antérieure associée, on observera un œil rouge et douloureux; sinon, il s’agira principalement d’un œil blanc et indolore.
Elle se manifeste par des myodésopsies et une baisse d’acuité variable, d’autant plus importante que le foyer est à proximité de la macula.
À l’examen du fond d’œil, il s’agit d’un foyer blanchâtre qui évolue vers une cicatrice atro-phique (fig. 8.3 et fig. 8.4), à partir de laquelle peuvent survenir des récidives.

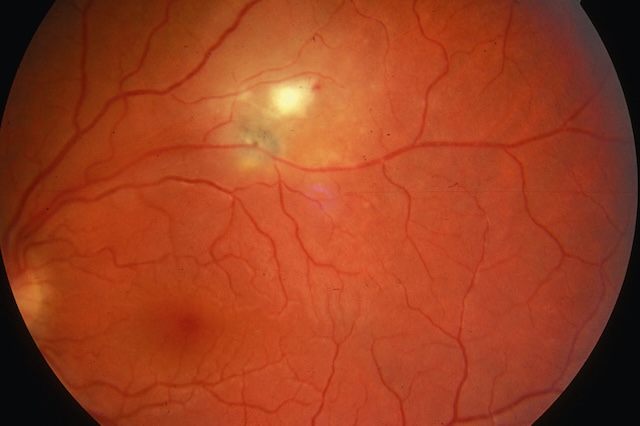
Photographie du fond d’œil gauche capturée en rétinophotographie couleur montrant un aspect classique de choriorétinite toxoplasmique. Au centre supérieur de l’image, on distingue un foyer blanchâtre récent, mal délimité, légèrement bombé et entouré d’un halo inflammatoire flou, traduisant une lésion active. Juste à proximité, un petit foyer pigmenté brun-noir, bien circonscrit, évoque une ancienne cicatrice rétinienne post-inflammatoire. Le contraste entre la lésion active claire et le foyer cicatriciel sombre est typique de la réactivation d’une toxoplasmose oculaire. Le réseau vasculaire rétinien apparaît globalement préservé, mais subtilement déplacé dans la zone périlésionnelle. L’ensemble du tableau est hautement suggestif d’une rechute sur cicatrice toxoplasmique ancienne.

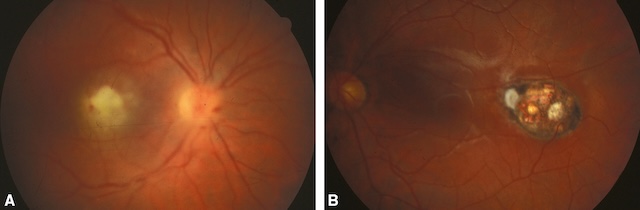
A. Foyer récent à l’œil droit proche de la macula. B. Foyer cicatriciel à l’œil gauche.
Photographies couleur du fond d’œil illustrant deux présentations distinctes mais complémentaires d’une toxoplasmose oculaire bilatérale. Sur l’image A, un foyer inflammatoire actif, blanchâtre, juxtavasculaire, se situe près de la papille optique, souligné par un discret œdème et une turgescence des vaisseaux rétiniens. L’image B montre une lésion ancienne bien pigmentée, aux bords irréguliers, avec des zones de cicatrisation choroïdienne brunâtres et des dépôts blanchâtres centraux, évoquant une nécrose rétinienne ancienne. Ces deux clichés traduisent l’évolution naturelle de la maladie : une phase active avec inflammation aiguë, puis une cicatrice pigmentée séquellaire.
Le traitement repose sur les antiparasitaires – association pyriméthamine (Malocide®) et sulfadiazine (Adiazine®) –, prescrits s’il existe une menace pour l’acuité visuelle.
4 175Autres causes de baisse de l’acuité visuelle avec œil rouge douloureux
- • un glaucome néovasculaire (diabète déséquilibré, OVCR) : présence d’une rubéose irienne visible lors de l’examen à la lampe à fente, parfois compliquée d’un hyphéma (par saignement des néovaisseaux iriens);
- • une endophtalmie : contexte postopératoire évocateur. Hypopion, fibrine en chambre antérieure visible à la lampe à fente; hyalite présente si le fond d’œil est réalisable.
B Baisse d’acuité visuelle avec œil blanc et indolore
L’examen du fond d’œil oriente le diagnostic.
1 Fond d’œil non visible ou mal visible par « trouble des milieux »
a Hémorragie intravitréenne
![]() Une hémorragie intravitréenne entraîne une baisse d’acuité visuelle souvent précédée d’une impression de « pluie de suie ».
Une hémorragie intravitréenne entraîne une baisse d’acuité visuelle souvent précédée d’une impression de « pluie de suie ».
La baisse d’acuité visuelle est très variable suivant l’importance de l’hémorragie : une hémorragie intravitréenne minime peut se manifester principalement par des myodésopsies, sans baisse d’acuité visuelle ou avec une baisse d’acuité visuelle minime; une hémorragie intra-vitréenne massive entraîne une baisse d’acuité visuelle sévère, au maximum une acuité visuelle réduite à la perception lumineuse.
![]() La cause de l’hémorragie est facile à reconnaître quand la rétine reste visible; ailleurs, une hémorragie massive rend la rétine invisible à l’examen du fond d’œil (fig. 8.5) : l’échographie B peut alors parfois orienter vers une étiologie (par exemple mise en évidence d’une déchirure rétinienne).
La cause de l’hémorragie est facile à reconnaître quand la rétine reste visible; ailleurs, une hémorragie massive rend la rétine invisible à l’examen du fond d’œil (fig. 8.5) : l’échographie B peut alors parfois orienter vers une étiologie (par exemple mise en évidence d’une déchirure rétinienne). ![]() L’échographie B est de toute façon toujours indiquée quand la rétine n’est pas visible pour éliminer la présence d’un décollement de la rétine (+++).
L’échographie B est de toute façon toujours indiquée quand la rétine n’est pas visible pour éliminer la présence d’un décollement de la rétine (+++).

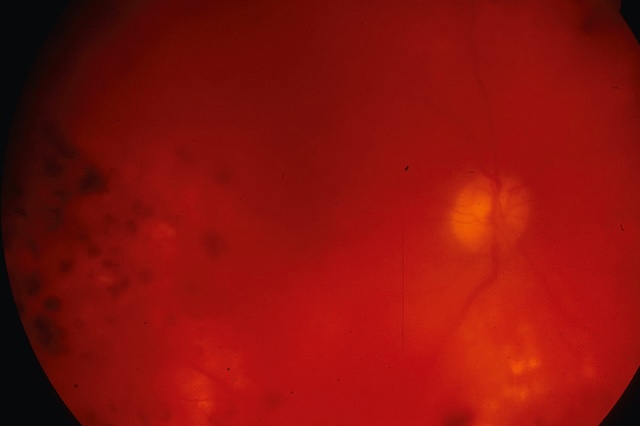
La rétine est masquée par l’hémorragie intravitréenne, et on ne perçoit plus que la papille et quelques cicatrices de laser dans le secteur temporal (bord gauche du cliché).
Image de fond d’œil en rétinographie couleur montrant une hémorragie intravitréenne de l’œil droit. La visualisation est globalement altérée par un voile rougeâtre diffus, typique d’un saignement dans le vitré, masquant partiellement les structures rétiniennes sous-jacentes. Malgré cette opacification, on distingue faiblement le nerf optique en temporal supérieur, à peine émergent dans l’ombre hémorragique, ainsi que quelques foyers plus denses d’exsudats jaunes dans la périphérie inférieure, suggérant un terrain pathologique chronique. De multiples taches sombres floues, dispersées dans le champ rétinien, correspondent à des amas de sang en suspension dans le corps vitré. Le flou visuel et la tonalité rouge globale de l’image sont caractéristiques d’un épisode aigu d’hémorragie intravitréenne, souvent en lien avec une rétinopathie diabétique proliférante ou une rupture vasculaire fragile. L’ambiance visuelle traduit bien la sévérité de l’épisode hémorragique et son impact fonctionnel immédiat.
![]() Les principales causes des hémorragies intravitréennes sont les suivantes :
Les principales causes des hémorragies intravitréennes sont les suivantes :
- • rétinopathie diabétique proliférante;
- • occlusions de forme ischémique de la veine centrale de la rétine ou d’une de ses branches;
- • déchirure rétinienne : une déchirure rétinienne, compliquée ou non de décollement de la rétine (voir plus loin), peut entraîner lors de sa survenue une hémorragie intravitréenne par rupture d’un vaisseau rétinien au sein de la déchirure;
- • syndrome de Terson : hémorragie intravitréenne uni- ou bilatérale associée à une hémorragie méningée par rupture d’anévrisme intracrânien (le syndrome de Terson peut également être associé à une hémorragie méningée d’origine traumatique);
- • plaie perforante ou pénétrante (contexte traumatique).
b Uvéite intermédiaire
![]() Ce terme est utilisé pour le sous-groupe d’uvéites où le vitré est le site principal de l’inflammation. Il peut y avoir une vascularite rétinienne périphérique ou un œdème maculaire associés à cette uvéite intermédiaire. Le terme de « pars planite » est réservé à un sous-groupe d’uvéites intermédiaires isolées ou idiopathiques, avec une inflammation à type de condensations vitréennes sans autre cause (pas de maladie systémique associée ou d’infection générale). La baisse d’acuité visuelle n’est en général pas brutale, mais peut être d’installation rapidement progressive, en quelques jours, et s’accompagne de myodésopsies. La douleur est généralement absente.
Ce terme est utilisé pour le sous-groupe d’uvéites où le vitré est le site principal de l’inflammation. Il peut y avoir une vascularite rétinienne périphérique ou un œdème maculaire associés à cette uvéite intermédiaire. Le terme de « pars planite » est réservé à un sous-groupe d’uvéites intermédiaires isolées ou idiopathiques, avec une inflammation à type de condensations vitréennes sans autre cause (pas de maladie systémique associée ou d’infection générale). La baisse d’acuité visuelle n’est en général pas brutale, mais peut être d’installation rapidement progressive, en quelques jours, et s’accompagne de myodésopsies. La douleur est généralement absente.
176L’examen met en évidence un trouble du vitré avec présence de cellules inflammatoires à l’examen à la lampe à fente ou « hyalite ».
2 Fond d’œil bien visible et anormal
a Occlusion de l’artère centrale de la rétine (OACR) ou d’une de ses branches (fig. 8.6)
![]() Voir chapitre 16.
Voir chapitre 16.

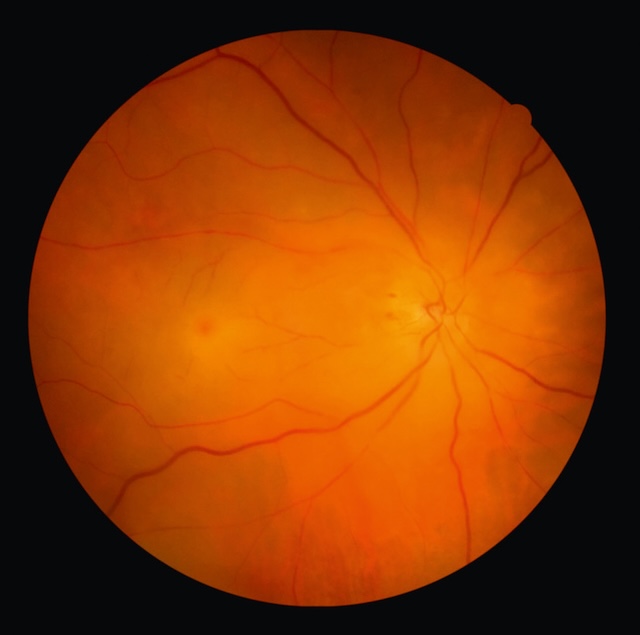
Ce cliché du fond d’œil droit capte avec une précision clinique l’expression visuelle d’une occlusion d’artère centrale de la rétine. L’image révèle un tableau frappant : la rétine apparaît pâle et œdémateuse, avec une teinte blanchâtre diffuse marquant l’ischémie aiguë du territoire rétinien. Le regard est naturellement attiré vers la macula qui se détache, rouge vif, comme une goutte de cerise au centre d’un halo opalin, une caractéristique classique de ce type d’occlusion. Ce contraste saisissant est le reflet direct du flux sanguin conservé dans la fovéola, structure fine et transparente, entourée d’un territoire infarci. On note aussi un net rétrécissement artériel, avec des vaisseaux fins, à peine remplis, témoignant d’une interruption brutale de la circulation artérielle. Il s’agit ici d’une photographie de fond d’œil obtenue via un rétinographe, un outil essentiel pour documenter ce type d’urgence ophtalmologique. Cette image parle d’un œil en détresse vasculaire, d’un épisode brutal aux conséquences visuelles majeures, souvent irréversibles si la prise en charge n’est pas immédiate.
b Occlusion de la veine centrale de la rétine (OVCR) ou d’une de ses branches (fig. 8.7 à fig. 8.10 et e-fig. 8.11)
Voir chapitre 17.

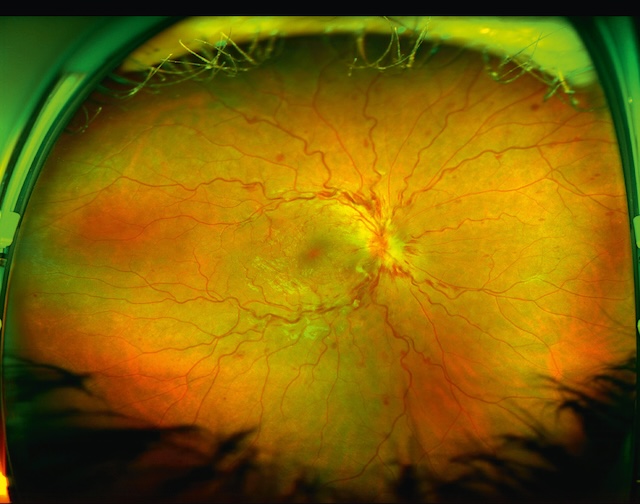
Photographie ultra-grand champ d’un fond d’œil droit, réalisée en imagerie rétinienne à large champ, montrant une occlusion de la veine centrale de la rétine. Le disque optique apparaît flou, congestionné et légèrement bombé, témoignant d’un œdème papillaire. Les veines rétiniennes sont visiblement dilatées et tortueuses sur tout le réseau vasculaire, avec de nombreuses hémorragies diffuses réparties dans les quatre quadrants, en nappe et en flammèches. L’arrière-plan rétinien présente des zones de stase veineuse et un aspect diffusément rouge sombre, évoquant un engorgement massif. Cette image traduit un tableau classique d’occlusion veineuse centrale avec retentissement aigu sur la perfusion rétinienne.

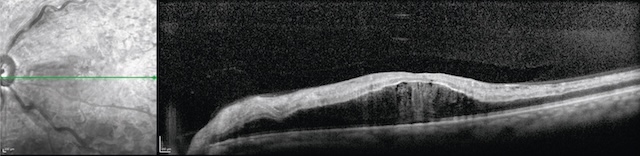
Image en coupe obtenue par tomographie en cohérence optique (OCT) de l’œil gauche, montrant un œdème maculaire central. Sur la partie gauche de l’image, un cliché en infrarouge structurel localise la coupe transversale, tandis que la partie droite révèle clairement un épaississement rétinien au niveau de la macula. La fovéa normale, habituellement creusée, est ici totalement comblée par une accumulation de fluide intrarétinien, formant un bombement central. De multiples cavités hypo-réflectives sont visibles dans les couches internes, caractéristiques d’un œdème cystoïde. La stratification rétinienne reste partiellement identifiable mais apparaît déformée, traduisant une atteinte fonctionnelle probable de la vision centrale. L’ensemble suggère une rétinopathie œdémateuse active nécessitant un traitement ciblé.

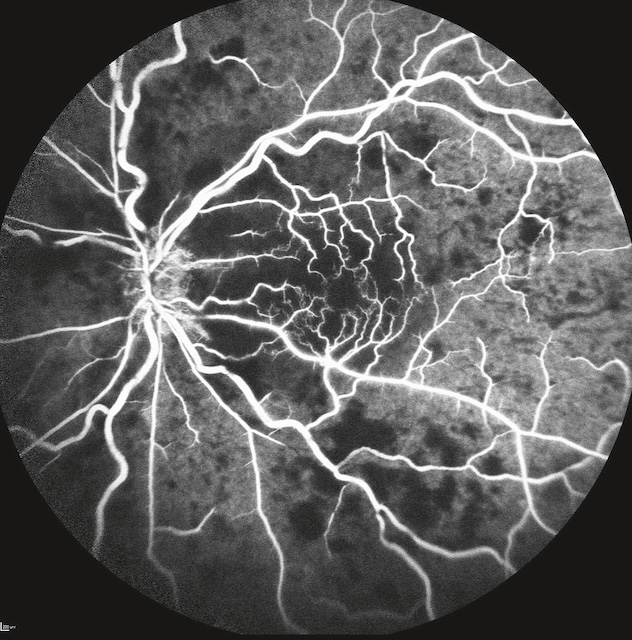
Image issue d’une angiographie à la fluorescéine montrant le fond d’œil d’un patient atteint d’une occlusion veineuse centrale de la rétine (OVCR) de type ischémique. Les vaisseaux veineux sont nettement dilatés, tortueux, et imprégnés de fluorescéine, contrastant fortement avec de larges zones de non-perfusion capillaire visibles en arrière-plan, traduisant une ischémie diffuse. Le centre de la rétine apparaît particulièrement appauvri en vascularisation, avec des territoires capillaires irréguliers et interrompus. Cette cartographie vasculaire altérée est typique des formes graves d’OVCR, avec un risque élevé de néovascularisation secondaire si non prise en charge rapidement.

Photographie prise en lampe à fente montrant une rubéose irienne majeure, dans un contexte d’occlusion veineuse centrale de la rétine (OVCR) ischémique. On observe, sur toute la surface de l’iris, une prolifération néovasculaire marquée, avec de multiples vaisseaux rouges fins, anormaux, irradiant depuis le bord pupillaire vers la périphérie irienne. Ces néovaisseaux s’étendent en arborisation dense, soulignant un état d’ischémie rétinienne sévère responsable d’un appel vasoprolifératif antérieur. La chambre antérieure est légèrement floutée, traduisant une réaction inflammatoire ou un début de glaucome néovasculaire. Le reflet pupillaire est diminué, avec un cristallin partiellement opacifié, et l’hyperhémie conjonctivale périphérique accentue le caractère pathologique global. L’image exprime de façon frappante la gravité de la situation, la rubéose étant souvent annonciatrice de complications majeures telles qu’un glaucome néovasculaire menaçant la fonction visuelle.
c 177178Dégénérescence maculaire liée à l’âge (DMLA) compliquée de néovaisseaux choroïdiens maculaires
Voir chapitre 15.
e œdème papillaire
Il s’agit d’un gonflement de la tête du nerf optique faisant suite à une élévation de la pression intracrânienne.
Devant un œdème papillaire, il convient d’éliminer une hypertension artérielle maligne (si bilatéral), une hypertension intracrânienne (si bilatéral), puis on s’oriente sur des causes de neuropathie optique inflammatoire.
En cas d’hypertension intracrânienne, les symptômes sont : céphalées, nausées/vomissements, troubles visuels transitoires à type d’éclipses visuelles, paralysie du nerf VI.
En cas névrite optique inflammatoire avec papillite, la baisse d’acuité visuelle prédomine.
f Décollement de la rétine rhegmatogène (fig. 8.12)
Il s’agit d’un décollement de la rétine (DR) secondaire à une déhiscence rétinienne (du grec rhegma = déchirure), s’opposant aux DR exsudatifs (comme au cours de l’HTA ou de la toxé-mie gravidique) et aux DR tractionnels (au cours notamment de la rétinopathie diabétique).

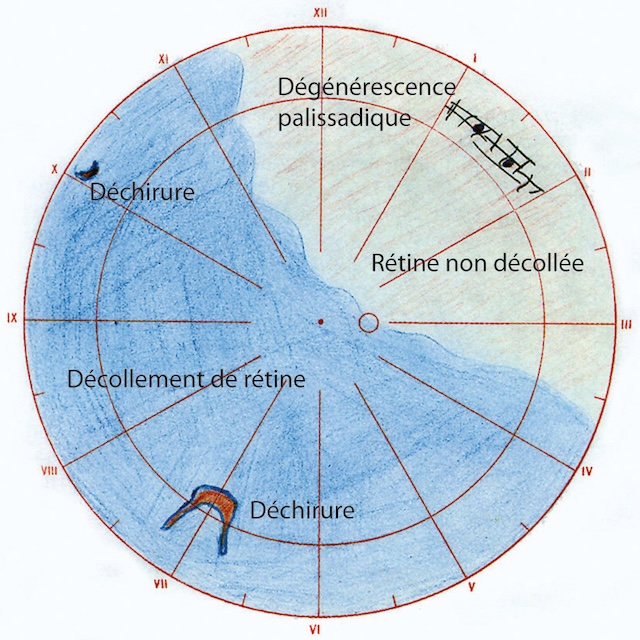
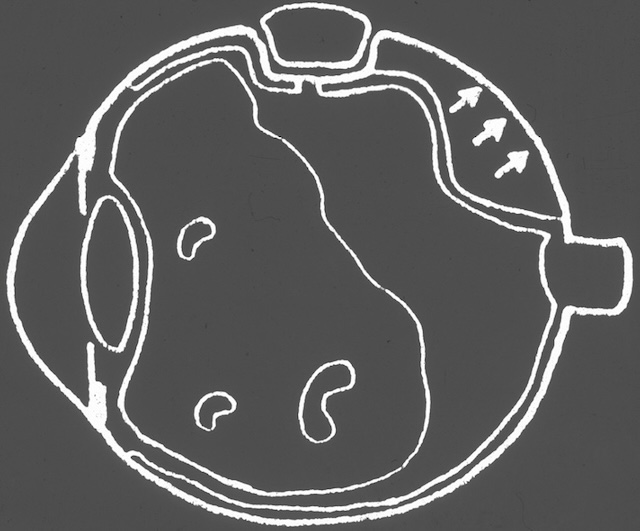
Schéma circulaire rétinien représentant un décollement de rétine de l’œil droit, vu selon la cartographie horaire utilisée en ophtalmologie. La zone en bleu indique une rétine décollée, s’étendant de 9h à 6h, englobant le quadrant temporal inférieur jusqu’à la région nasale inférieure. Deux déchirures rétiniennes sont identifiées : l’une vers 8h, l’autre plus large à 6h, chacune servant de point d’entrée au liquide sous-rétinien. En haut, autour de 1h, une dégénérescence palissadique est annotée, sur une rétine encore attachée. La moitié temporo-supérieure, teintée en beige, reste non décollée. Cette illustration synthétise l’aspect topographique d’un décollement rhegmatogène avec éléments causals clairement localisés.
![]() La survenue d’une déhiscence au niveau de la rétine périphérique avec un défect de pleine épaisseur de la rétine neurosensorielle (voir chapitre 1) peut permettre le passage de vitré liquéfié depuis la cavité vitréenne dans l’espace sous-rétinien (entre la rétine neurosensorielle et l’épithélium pigmentaire); ce liquide sous-rétinien (LSR) va soulever la rétine de proche en proche : c’est le DR rhegmatogène (fig. 8.13).
La survenue d’une déhiscence au niveau de la rétine périphérique avec un défect de pleine épaisseur de la rétine neurosensorielle (voir chapitre 1) peut permettre le passage de vitré liquéfié depuis la cavité vitréenne dans l’espace sous-rétinien (entre la rétine neurosensorielle et l’épithélium pigmentaire); ce liquide sous-rétinien (LSR) va soulever la rétine de proche en proche : c’est le DR rhegmatogène (fig. 8.13).

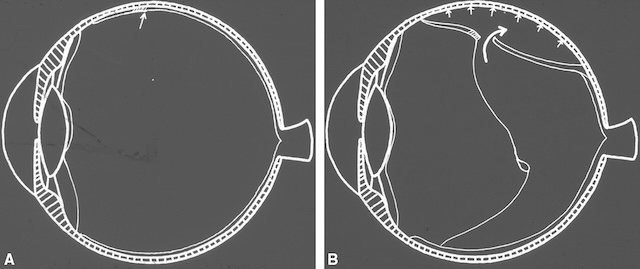
La survenue d’une déhiscence rétinienne en périphérie rétinienne permet le passage de liquide dans l’espace sous-rétinien; l’épithélium pigmentaire assure la résorption de ce liquide sous-rétinien, mais son débit est insuffisant et le liquide s’accumule sous la rétine, entraînant l’extension du décollement de la rétine.
Schéma anatomique en deux parties illustrant la physiopathologie du décollement de la rétine. Dans l’image A, l’œil est représenté en coupe sagittale avec une structure rétinienne encore adhérente à l’épithélium pigmentaire. Une petite flèche à la périphérie supérieure indique une zone de fragilité ou de rupture rétinienne initiale. L’image B montre le stade évolutif du processus : un soulèvement net de la rétine neurosensorielle s’est produit à travers une déchirure, marquée par une large flèche courbée. Le décollement progresse vers la partie postérieure du globe, créant une cavité entre la rétine et l’épithélium sous-jacent, simulant un véritable clivage. Ce mécanisme est typique du décollement de rétine rhegmatogène, où une brèche permet l’infiltration de liquide sous-rétinien, détachant progressivement la rétine.
Il reconnaît trois étiologies principales :
- • DR idiopathique, le plus souvent chez le sujet âgé (compliquant un décollement postérieur du vitré si sujet âgé);
- • myopie, notamment myopie forte (myopie supérieure à -6 dioptries); le risque de DR rheg-matogène croît avec le degré de myopie;
- • 179chirurgie de la cataracte (DR de l’aphaque ou du pseudophaque), qui se complique d’un DR dans environ 2 % des cas, dans un délai variable, parfois plusieurs années après l’intervention sur le cristallin.
![]() L’évolution spontanée est très péjorative : elle se fait vers l’extension inexorable du DR, qui englobe la macula, puis la totalité de la rétine.
L’évolution spontanée est très péjorative : elle se fait vers l’extension inexorable du DR, qui englobe la macula, puis la totalité de la rétine.
![]() Le traitement est uniquement chirurgical. En attendant sa mise en œuvre, le regard du patient doit être positionné vers le bas,
Le traitement est uniquement chirurgical. En attendant sa mise en œuvre, le regard du patient doit être positionné vers le bas, ![]() pour limiter la progression du DR. Le principe du traitement est d’obturer la déhiscence rétinienne périphérique, permettant de stopper le passage de LSR. Le LSR résiduel est ensuite résorbé par l’épithélium pigmentaire et la choroïde, permettant à la rétine de se réappliquer (fig. 8.14).
pour limiter la progression du DR. Le principe du traitement est d’obturer la déhiscence rétinienne périphérique, permettant de stopper le passage de LSR. Le LSR résiduel est ensuite résorbé par l’épithélium pigmentaire et la choroïde, permettant à la rétine de se réappliquer (fig. 8.14).

Noter à la partie supérieure de l’œil une indentation en coupe permettant de rapprocher la paroi sclérale de la rétine.
Schéma anatomique en coupe transversale simplifiée d’un globe oculaire, illustrant le principe du traitement chirurgical du décollement de rétine. On y voit clairement la rétine décollée formant une bulle au sein du vitré, séparée de la couche sous-jacente. Des flèches pointent vers une déhiscence rétinienne, identifiée comme la voie d’entrée du liquide sous-rétinien. L’objectif du geste chirurgical est de combler cette brèche, permettant ainsi au liquide accumulé de se résorber naturellement par l’épithélium pigmentaire. Une fois la fuite colmatée, la rétine peut se repositionner contre la paroi interne de l’œil. Ce dessin illustre de manière directe et pédagogique la mécanique de la réapplication rétinienne post-intervention.
![]() Les signes cliniques sont fonctionnels : myodésopsies, suivies de phosphènes correspondant à la survenue de la déchirure rétinienne, puis d’une amputation du champ visuel périphérique, 180correspondant à la constitution du DR; lorsque le DR soulève la macula, il entraîne alors une baisse d’acuité visuelle (e-fig. 8.1 B et e-fig. 8.16).
Les signes cliniques sont fonctionnels : myodésopsies, suivies de phosphènes correspondant à la survenue de la déchirure rétinienne, puis d’une amputation du champ visuel périphérique, 180correspondant à la constitution du DR; lorsque le DR soulève la macula, il entraîne alors une baisse d’acuité visuelle (e-fig. 8.1 B et e-fig. 8.16).
- • fait le diagnostic : la rétine apparaît en relief, mobile, formant de volumineux plis;
- • recherche la déhiscence causale (fig. 8.17 à fig. 8.19); il doit s’attacher à rechercher plusieurs déchirures, les déchirures multiples étant fréquentes et la méconnaissance d’une ou de plusieurs déchirures exposant à un échec du traitement chirurgical.

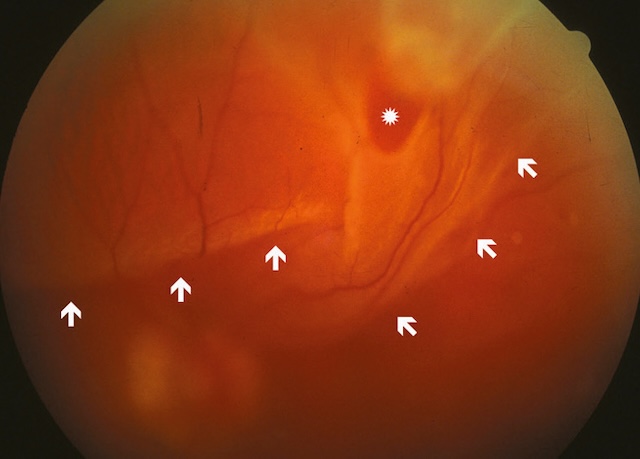
Fig. 8.17 Aspect du fond d’œil dans un décollement de la rétine secondaire à une volumineuse déchirure située en temporal supérieur.
Limites du décollement (flèches), déchirure (étoile).Cette image montre un fond d’œil typique d’un décollement de la rétine, secondaire à une large déchirure localisée dans le quadrant temporal supérieur. On distingue nettement une zone de soulèvement rétinien, marquée par un plissement des vaisseaux et une déformation de la trame vasculaire normale. Les flèches blanches indiquent la limite ondulée de la rétine décollée, qui prend un aspect légèrement opalescent et bombé. La lumière réfléchie en haut de l’image correspond à une condensation vitréenne ou à une traction localisée. L’ensemble du champ rétinien apparaît altéré, avec des zones de rétraction et une perte de netteté périphérique, caractéristiques d’un décollement évolutif. Ce tableau clinique nécessite une prise en charge rapide pour éviter une atteinte irréversible de la fonction visuelle.

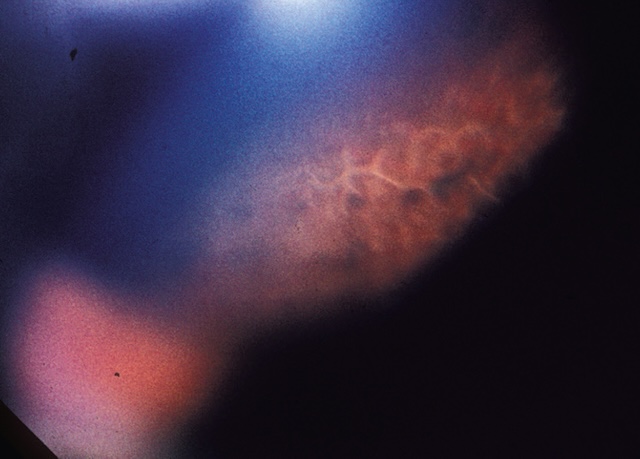
Fig. 8.18 Dégénérescence palissadique (examen de la périphérie du fond d’œil à la lampe à fente). Photographie prise au fond d’œil en périphérie rétinienne, obtenue à la lampe à fente avec lentille à trois miroirs, illustrant une dégénérescence palissadique. L’image révèle une bande allongée, brunâtre à rosée, avec un motif typique en palissade : aspect linéaire et segmenté, formé par des zones de raréfaction et d’épaississement du tissu rétinien, alternant avec des vaisseaux pigmentés. Cette dégénérescence s’observe en périphérie temporale et supérieure de la rétine, souvent de façon bilatérale, et prédispose au développement de déchirures rétiniennes. Le fond est légèrement bleuté par la transillumination, accentuant le contraste des lésions. Ce type d’image est évocateur d’un terrain à risque pour le décollement de rétine, justifiant une surveillance régulière, surtout chez les myopes.

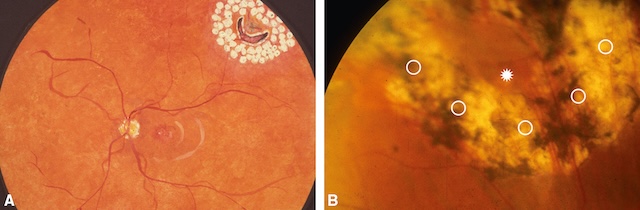
Fig. 8.19 Traitement préventif du décollement de la rétine.
A. Représentation schématique d’une photocoagulation préventive d’une déchirure rétinienne non compliquée de décollement de rétine. B. Cicatrices de photocoagulation autour d’une déchirure rétinienne (déchirure : étoile; cicatrices de photocoagulation : cercles).Ces deux fonds d’œil illustrent des approches de traitement préventif du décollement de la rétine. L’image A montre une rétine d’apparence saine avec, dans le quadrant supérieur droit, un foyer de dégénérescence périphérique entouré de multiples impacts de photocoagulation au laser, organisés en couronne autour d’une déchirure en fer à cheval, afin de sceller la zone à risque. L’image B, quant à elle, dévoile une large zone pigmentée irrégulière, résultat d’un traitement plus étendu, probablement suite à des lésions préexistantes. Des cercles blancs marquent les anciennes localisations des impacts laser et une étoile centrale attire l’attention sur la zone principale de renforcement. Ces clichés mettent en lumière l’importance d’un traitement précoce pour éviter les complications graves.
3 181Anomalies de la vision d’apparition brutale avec fond d’œil visible et normal
a Névrite optique retrobulbaire (NORB)
Voir chapitre 19.
La NORB se traduit par les éléments suivants :
- • importante baisse d’acuité visuelle unilatérale rapidement progressive (en quelques jours);
- • douleurs oculaires augmentées lors des mouvements oculaires;
- • réflexe photomoteur direct diminué;
- • examen du fond d’œil normal (plus rarement, œdème papillaire modéré);
- • scotome central ou cœcocentral du champ visuel.
b Atteintes des voies optiques chiasmatiques et rétrochiasmatiques
Voir chapitre 7.
Une atteinte chiasmatique donne le plus souvent une hémianopsie bitemporale d’installation progressive, la cause étant le plus souvent une compression d’origine tumorale.
Devant une hémianopsie (fig. 8.20) ou une quadranopsie latérale homonyme (fig. 8.21) par atteinte des voies optiques rétrochiasmatiques, l’installation brutale évoque une étiologie vas- culaire, alors qu’une installation progressive évoque une étiologie tumorale.

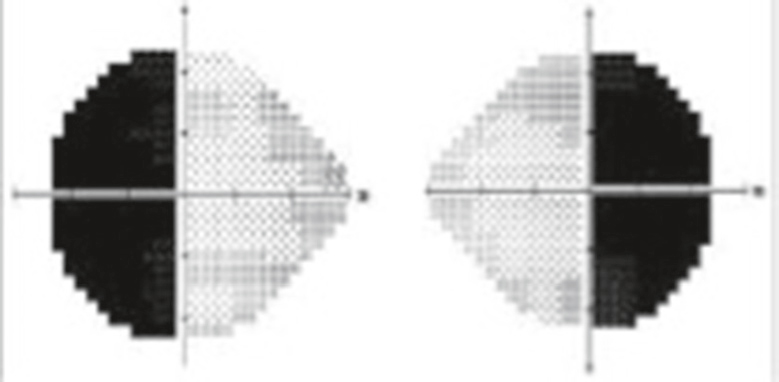
Diagramme en niveaux de gris issu d’un champ visuel Humphrey, révélant une hémianopsie bitemporale typique. Chaque moitié du visuel correspond respectivement à l’œil droit et à l’œil gauche, séparés par une ligne verticale centrale. Dans les deux cas, les moitiés temporales, c’est-à-dire les zones latérales de chaque œil, apparaissent complètement noircies, signe d’une perte de champ visuel bien délimitée. Cette disparition symétrique des champs temporaux, parfaitement respectueuse de la ligne médiane verticale, évoque très directement une atteinte au niveau du chiasma optique, généralement provoquée par une compression, comme celle engendrée par un adénome hypophysaire. À l’inverse, les champs nasaux restent intacts et montrent des plages claires traduisant une sensibilité visuelle préservée. L’image met donc en évidence un déficit précis, bilatéral et topographiquement chiasmatique, sans aucune ambiguïté.


Cette image correspond à un champ visuel réalisé avec la méthode automatisée Humphrey, illustrant de façon nette une hémianopsie latérale homonyme gauche. On y observe, pour les deux yeux, une perte de sensibilité complète dans l’hémichamp gauche de chaque rétine, matérialisée ici par des zones noircies en miroir. Cette atteinte typique traduit une lésion rétrochiasmatique, vraisemblablement localisée au niveau du tractus optique droit, du corps genouillé latéral droit, des radiations optiques ou du cortex visuel occipital droit. L’aspect régulier et symétrique de la perte dans les deux hémichamps temporaux des yeux met en évidence le caractère neurologique de l’atteinte, souvent associée à des AVC, des tumeurs cérébrales ou des traumatismes. Ce type de visuel n’est pas une simple photo, mais un rendu cartographique des réponses sensorielles du patient, utilisé en neuro-ophtalmologie pour préciser la topographie des lésions visuelles centrales.
![]() Les troubles visuels récents suivants doivent faire réaliser une imagerie cérébrale en urgence :
Les troubles visuels récents suivants doivent faire réaliser une imagerie cérébrale en urgence :
- • cécité monoculaire transitoire (CMT);
- • névrite optique rétrobulbaire (NORB);
- • atteinte du champ visuel de type latérale homonyme ou bitemporale;
- • OACR;
- • œdème papillaire bilatéral (fig. 8.22 et fig. 8.23).

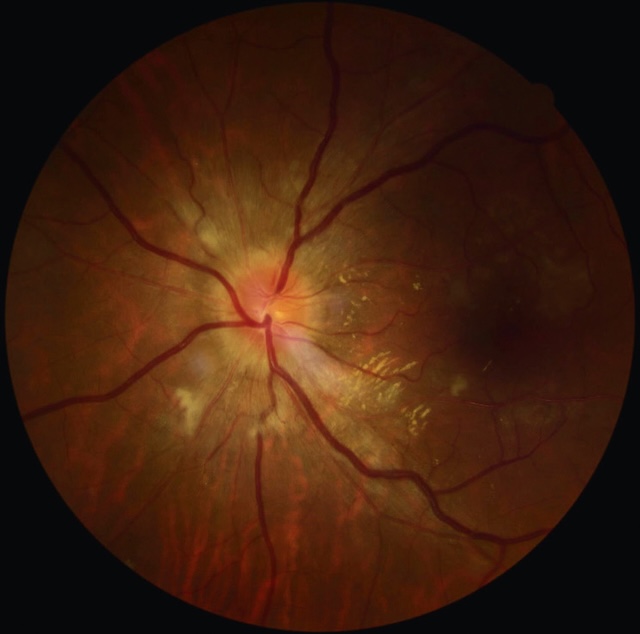
Fig. 8.22 Photographie du fond d’œil gauche montrant un volumineux œdème papillaire dans le cadre d’une hypertension artérielle maligne. Photographie couleur du fond d’œil gauche capturée par rétinographie, montrant un œdème papillaire massif en contexte d’hypertension artérielle maligne. Le nerf optique est gonflé, ses bords sont flous et les vaisseaux émanant de la papille apparaissent engorgés et tortueux. Plusieurs exsudats cotonneux blanchâtres sont visibles en couronne péripapillaire, traduisant une ischémie axoplasmique. On note également des zones d’exsudation lipidiques jaune pâle dans la région maculaire, et un fond rétinien globalement congestionné. L’ensemble reflète une atteinte hypertensive sévère, avec retentissement direct sur la microcirculation rétinienne et le nerf optique, nécessitant une prise en charge systémique urgente.

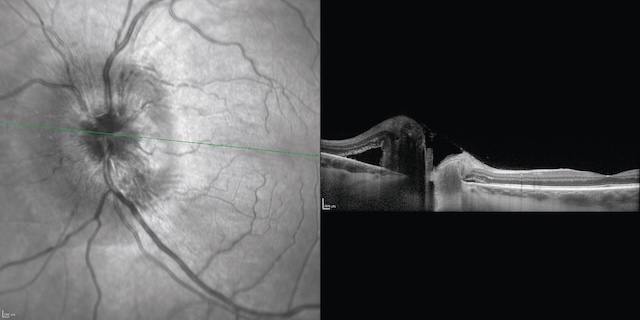
Fig. 8.23 Photographie du fond d’œil gauche et coupe en OCT du même patient qu’en figure 8.22.
L’œdème papillaire est mieux visible en cliché infrarouge, et il existe une surélévation en OCT (coupe passant par la papille).Montage en deux volets illustrant à gauche une photographie du fond d’œil gauche en infrarouge structurel, et à droite une coupe en tomographie en cohérence optique (OCT) horizontale passant par la macula. L’image en fond d’œil montre un nerf optique au contour flou, avec une hyperréflectivité maculaire évoquant une traction vitréomaculée ou une membrane épirétinienne. Sur la coupe OCT correspondante, on observe une distorsion nette du relief fovéal, avec soulèvement de la rétine centrale et désorganisation architecturale des couches internes. Une traction antéro-postérieure visible entraîne une cavitation sous-fovéolaire et un soulèvement rétinien focalisé. Ce type de présentation évoque une traction vitréomaculaire symptomatique, nécessitant un suivi spécialisé, voire une intervention chirurgicale.
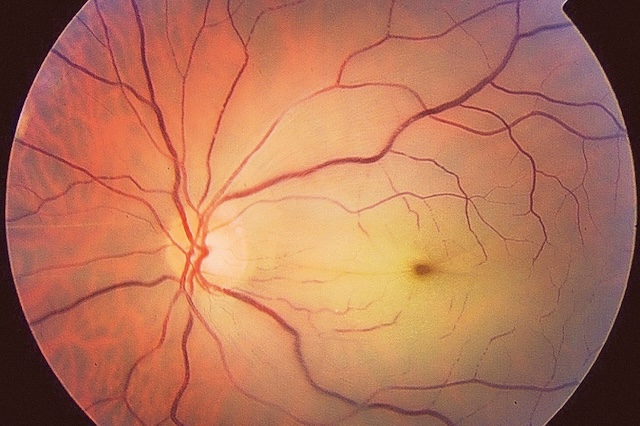
Fig. 8.24 Photographie couleur du fond d’œil réalisée par rétinographie, présentant un aspect parfaitement normal d’un fond rétinien. La papille optique est bien définie, de teinte rosée, avec des bords nets et un creux central physiologique. Les vaisseaux rétiniens, artérioles et veinules, émergent harmonieusement du disque optique, se ramifiant progressivement jusqu’en périphérie sans anomalie de calibre ni signe d’exsudation. La macula, située temporalement par rapport à la papille, apparaît légèrement plus pigmentée, avec une fovéa centrale discrètement déprimée, typique d’un œil sain. Aucun signe d’hémorragie, d’œdème ou de lésion dégénérative n’est visible, traduisant une anatomie rétinienne parfaitement conservée.
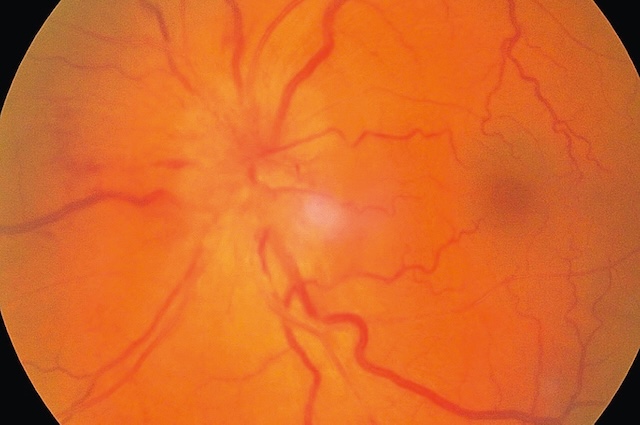
Fig. 8.25 Photographie couleur du fond d’œil réalisée en rétinographie, offrant une vue nette de la papille optique et du réseau vasculaire rétinien. La tête du nerf optique apparaît élargie, aux bords flous, avec une hyperhémie diffuse, traduisant un œdème papillaire. Les vaisseaux émergeant de la papille montrent une tortuosité marquée, et certaines veines semblent engorgées, accentuant l’aspect congestif du disque. Le fond rétinien périphérique reste homogène, bien que l’on distingue quelques capillaires légèrement dilatés. À droite du centre de l’image, la macula est identifiable mais moins contrastée, probablement en raison du flou optique provoqué par l’œdème. Cet aspect évoque un œdème papillaire d’origine intracrânienne, possiblement lié à une hypertension intracrânienne ou une neuropathie optique. L’image saisit avec précision la topographie et la texture de cette atteinte du nerf optique.
C 182183Anomalies transitoires de la vision
1 Cécité monoculaire transitoire (CMT)
![]() Une disparition totale de la vision, d’apparition aiguë, d’une durée de quelques minutes, spontanément résolutive constitue l’amaurose fugace; elle correspond à un accident isché-mique rétinien transitoire. Il est nécessaire de réaliser un fond d’œil pour rechercher un embole rétinien.
Une disparition totale de la vision, d’apparition aiguë, d’une durée de quelques minutes, spontanément résolutive constitue l’amaurose fugace; elle correspond à un accident isché-mique rétinien transitoire. Il est nécessaire de réaliser un fond d’œil pour rechercher un embole rétinien.
C’est une urgence diagnostique en raison du risque de survenue d’une occlusion artérielle rétinienne constituée ou d’un AVC ischémique.
Elle doit faire rechercher avant tout un athérome carotidien ou une cardiopathie emboligène (voir chapitre 16). Une artérite gigantocellulaire (maladie de Horton) doit aussi être systématiquement évoquée.
4 Scotome scintillant (aura migraineuse)
![]() Bilatéral, accompagné de flashs colorés, s’étendant progressivement à un hémichamp visuel, le scotome scintillant évoque une migraine ophtalmique. Le trouble visuel régresse en 15 à 20 minutes environ, laissant la place à une céphalée pulsatile, volontiers hémicrânienne et controlatérale. Dans certains cas, le scotome scintillant est isolé, sans céphalée.
Bilatéral, accompagné de flashs colorés, s’étendant progressivement à un hémichamp visuel, le scotome scintillant évoque une migraine ophtalmique. Le trouble visuel régresse en 15 à 20 minutes environ, laissant la place à une céphalée pulsatile, volontiers hémicrânienne et controlatérale. Dans certains cas, le scotome scintillant est isolé, sans céphalée.
 184Compléments en ligne
184Compléments en ligne
Madame P., âgée de 70 ans, se présente aux urgences ophtalmologiques pour baisse d’acuité visuelle brutale et non douloureuse de l’œil droit, ce matin au réveil. Son acuité visuelle est de 1/20e. L’examen du fond d’œil est celui-ci.
Quelle(s) affirmation(s) est(sont) exacte(s) ?
Parmi les propositions suivantes, laquelle (lesquelles) se manifeste(nt) par un œil blanc douloureux ?
Monsieur N., âgé de 68 ans, se présente aux urgences pour une baisse d’acuité visuelle brutale à 1/20e de l’œil droit. Il a comme antécédents généraux : une hypertension artérielle (HTA) et un syndrome d’apnées obstructives du sommeil (SAOS). Le fond d’œil est ci-dessous.
185Quelle(s) est/sont la/les affirmation(s) exacte(s) ?
- A Le diagnostic le plus probable est une névrite optique rétrobulbaire de l’œil droit
- B Vous prescrivez en urgence une NFS, VS, CRP
- C La biopsie des artères temporales est indispensable pour le diagnostic, et la mise en place d’un traitement
- D Il n’existe pas de risque de bilatéralisation
- E Un déficit cœcocentral au champ visuel est typiquement associé à cette pathologie
Un patient de 45 ans se présente aux urgences avec un œil droit rouge et douloureux. Il se plaint d’une baisse d’acuité visuelle (BAV) homolatérale importante. Quelles sont les réponses vraies ?
Monsieur Z., âgé de 60 ans, est transféré en ambulance à votre cabinet d’ophtalmologie pour un œil droit rouge et douloureux. Son acuité visuelle corrigée est limitée à « voir bouger la main » à l’œil droit et 10/10es à l’œil gauche. Votre interrogatoire a éliminé un traumatisme oculaire récent. Monsieur Z. décrit des douleurs oculaires et péri-oculaires très intenses (échelle visuelle analogique [EVA] à 9/10) survenues soudainement à 16 heures 30 cet après-midi. Il montre avec sa main la région orbitaire douloureuse. Ces douleurs sont accompagnées de nausées, vomissements. Il perçoit des halos autour des lumières. Il disait voir parfaitement avant cet épisode.
 Réponses
Réponses
Il s’agit d’une occlusion de l’artère centrale de la rétine de l’œil gauche. Il existe une baisse de l’acuité visuelle (BAV) brutale (voit bouger la main, compte les doigts) associée à un œil blanc, indolore.
Les signes cliniques du fond d’œil sont :
- • œdème blanc rétinien ischémique;
- • artères grêles;
- • cerise (macula rouge cerise) : la fovéola, qui n’est vascularisée que par la choroïde, garde sa coloration normale et apparaît plus rouge par contraste avec tout le reste de la rétine d’aspect « blanc laiteux » (« tache rouge cerise de la macula »);
- • RPM aboli (mydriase aréflexive : abolition du RPM direct mais conservation du RPM consensuel).
C’est un AVC jusqu’à preuve du contraire. Il convient de réaliser un bilan cardiovasculaire complet (recherche de diabète, cholestérol, triglycérides, NFS, VS, CRP), écho-Doppler des carotides, ECG, échographie cardiaque) et une IRM cérébrale en urgence.
Diagnostics à évoquer devant une BAV brutale, œil blanc, indolore : OACR, occlusion de la veine centrale de la rétine (OVCR), neuropathie optique ischémique antérieure (NOIA), hémorragie intravitréenne, décollement de rétine macula off, cécité corticale.
Neuropathie optique ischémique antérieure (NOIA) : ischémie de la tête du nerf optique, par occlusion de l’artère ciliaire postérieure ou d’une de ses branches.
Il existe souvent un ou des épisodes d’amaurose fugace précédant la NOIA constituée. Les signes biologiques retrouvés sont une accélération de la VS et une élévation de la CRP.
Biopsie de l’artère temporale : présence de cellules géantes, épaississement de l’intima et diminution de la taille de la lumière artérielle. Elle ne doit pas retarder la mise en place d’un traitement par bolus de corticoïdes.
La conjonctivite n’est pas associée à une BAV.
Le diagnostic à évoquer en urgence est une crise de fermeture de l’angle. Les facteurs de risque sont : une hypermétropie, une chambre antérieure étroite et une cataracte (facteur cristallinien). La tension oculaire doit être mesurée et sera très élevée. L’examen de l’œil controlatéral met en évidence généralement un angle irido-cornéen étroit. La prise en charge sera médicale en urgence.
 Compléments en ligne
Compléments en ligne
Des compléments numériques sont associés à ce chapitre. Ils sont indiqués dans le texte par un picto. Pour voir ces compléments, connectez-vous sur http://www.em-consulte.com/ e-complements/478662 et suivez les instructions.

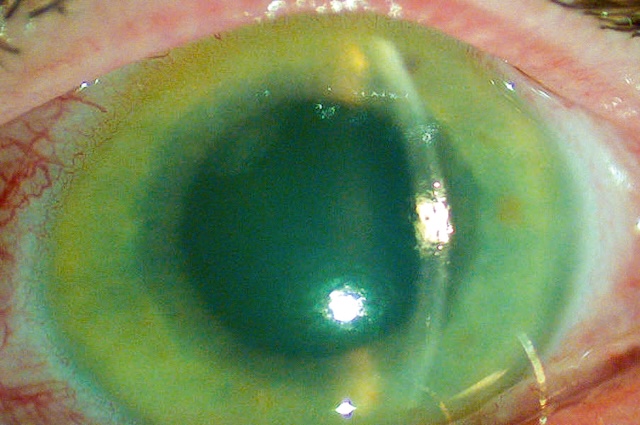
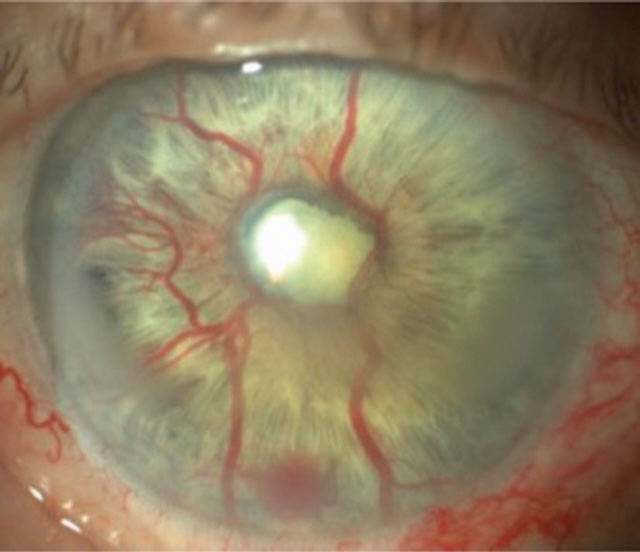
Cette photographie en lampe à fente illustre un épisode typique de crise aiguë par fermeture de l’angle, et l’image en dit long avant même d’ouvrir le dossier clinique. La cornée est trouble, œdémateuse, laissant à peine deviner les structures intraoculaires. On note ce halo diffus, signe d’un œdème stromal conséquent, qui témoigne d’une élévation brutale de la pression intraoculaire. L’iris semble bombé, la chambre antérieure est étroite, voire virtualisée en périphérie. C’est un œil sous tension, douloureux, souvent accompagné d’un tableau général fait de nausées, de baisse visuelle rapide et de photophobie. Ce type de cliché est capital pour capter sur le vif une urgence ophtalmologique redoutée, car chaque heure compte pour préserver la fonction visuelle. L’analyse montre ici un cliché biomédical capturé à la lampe à fente, permettant une visualisation directe de l’état cornéen et des anomalies de l’angle irido-cornéen. C’est une image qui parle d’elle-même : tension, inflammation, et menace immédiate sur l’œil.

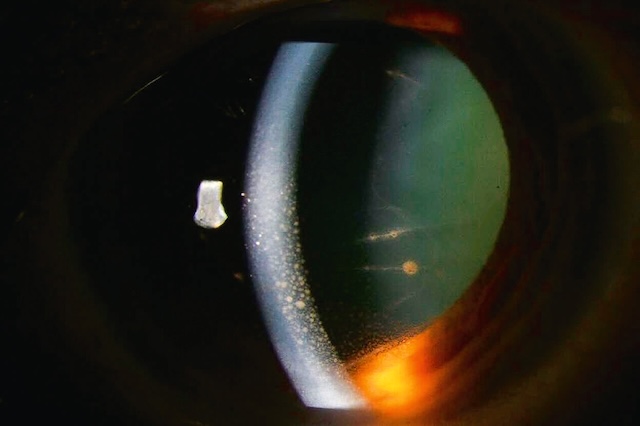
Ce cliché en lampe à fente, capturé en fente large, met en évidence une constellation de précipités rétrocornéens blanchâtres à l’allure granuleuse, disposés en semis fins sur la face postérieure de la cornée. Ces dépôts, à l’apparence légèrement bosselée, trahissent la présence d’une uvéite antérieure d’allure granulomateuse, une inflammation intraoculaire caractérisée par une réaction cellulaire plus organisée, souvent associée à des pathologies systémiques comme la sarcoïdose, la tuberculose ou d’autres étiologies inflammatoires chroniques. L’éclairage oblique, bien maîtrisé, révèle une chambre antérieure aux contours nets avec un reflet spéculaire cornéen encore préservé, accentuant la visibilité des précipités fixés à l’endothélium. La profondeur du champ et le jeu de lumières offrent un aperçu clinique d’une grande finesse, capturant non seulement la pathologie en elle-même mais aussi l’ambiance inflammatoire subtile de l’œil. Ce type d’image relève de la photographie biomédicale spécialisée, indispensable pour documenter l’évolution d’une uvéite chronique et orienter les investigations étiologiques.

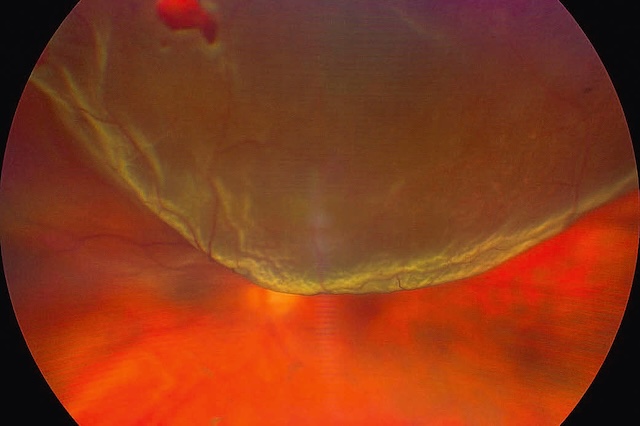
Image ultra grand champ prise par rétinographie couleur avec système Zeiss Clarus, illustrant un décollement de rétine supérieur de type bulleux au niveau de l’œil gauche. La rétine, habituellement plaquée contre la paroi interne du globe oculaire, apparaît ici soulevée en nappe ondulée, formant une bulle translucide flottant dans le champ supérieur de l’image. Ce soulèvement net, aux contours bien délimités, est typique d’un décollement rhegmatogène, secondaire à une petite déchirure rétinienne localisée en supérieur, invisible ici mais responsable du passage du liquide sous-rétinien. Le pôle inférieur de la rétine reste partiellement en place, permettant de mieux apprécier le contraste entre la zone décollée, plus terne et floue, et la zone encore attachée, plus rouge et bien vascularisée. Une petite hémorragie flotte dans le vitré supérieur gauche, signe d’un traumatisme ou d’une traction antérieure. Cette vue capture avec précision la dynamique d’un décollement en phase évolutive.

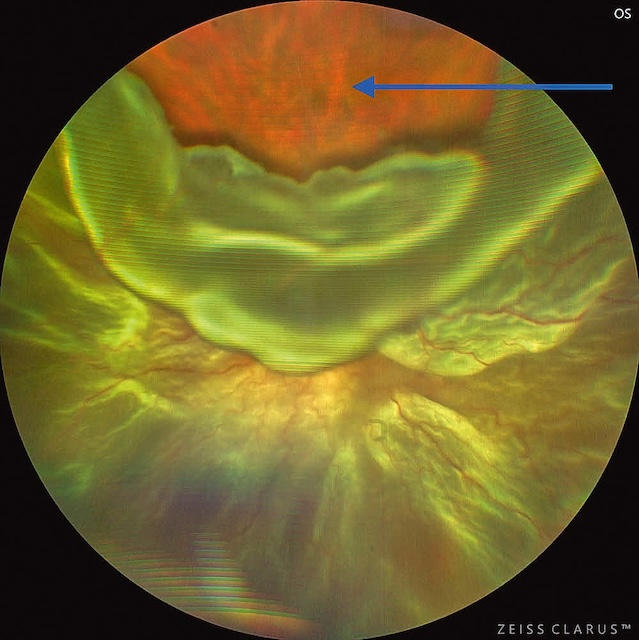
Cette image spectaculaire en fond d’œil ultra-grand champ met en lumière un décollement de rétine total de l’œil gauche, capté grâce à un système d’imagerie de haute définition, ici probablement un Zeiss Clarus. Au centre de l’image, une vaste déchirure rétinienne occupe la région supérieure, précisément autour de la position horaire de midi, laissant s’échapper le fluide sous-rétinien qui sépare la rétine sensorielle de l’épithélium pigmentaire. Le relief sinueux et bombé de la rétine décollée, flottante, donne un effet de voile ondulé, accentué par les nuances vert-jaune et les variations de réflectivité. L’organisation en plis radiaires et la texture en vagues immobiles soulignent la tension mécanique exercée par la traction vitréo-rétinienne à l’origine de la déchirure. Ce type de document visuel est essentiel non seulement pour le diagnostic et le suivi post-intervention mais aussi pour comprendre l’étendue de la lésion avant une chirurgie de rétinopexie ou de vitrectomie. Ce cliché relève d’une imagerie rétinienne spécialisée, typiquement utilisée en rétinopathie chirurgicale.
