CHAPITRE 16: Item 82 Occlusions artérielles rétiniennes (OAR) et neuropathie optique ischémique antérieure aiguë (NOIAA)
Dr T. Ferreira de Moura, CHU de Reims
Situations cliniques de départ
 42 – Hypertension artérielle : facteurs de risque associés à la survenue d’une NOIA non artéritique.
42 – Hypertension artérielle : facteurs de risque associés à la survenue d’une NOIA non artéritique.
 138 – Anomalie de la vision : la NOIA se manifeste par une baisse de l’acuité visuelle parfois profonde.
138 – Anomalie de la vision : la NOIA se manifeste par une baisse de l’acuité visuelle parfois profonde.
 203 – Élévation de la protéine C réactive (CRP) : bilan de NOIA artéritique.
203 – Élévation de la protéine C réactive (CRP) : bilan de NOIA artéritique.
 178 – Demande/prescription raisonnée et choix d’un examen diagnostique : le bilan de la NOIA doit écarter une artérite gigantocellulaire en premier lieu. Le bilan de la NOIA non artéritique est celui des facteurs de risques cardiovasculaires.
178 – Demande/prescription raisonnée et choix d’un examen diagnostique : le bilan de la NOIA doit écarter une artérite gigantocellulaire en premier lieu. Le bilan de la NOIA non artéritique est celui des facteurs de risques cardiovasculaires.
 251 – Prescrire des corticoïdes par voie générale ou locale : indiqué en cas de NOIA artéritique.
251 – Prescrire des corticoïdes par voie générale ou locale : indiqué en cas de NOIA artéritique.
 352 – Expliquer un traitement au patient : corticothérapie prolongée en cas d’artérite gigantocellulaire
352 – Expliquer un traitement au patient : corticothérapie prolongée en cas d’artérite gigantocellulaire
Hiérarchisation des connaissances
| Rang | Rubrique | Intitulé et descriptif |
|
|
Identifier une urgence | Conduite à tenir devant une baisse de vision brutale avec œil blanc et identification des urgences |
|
|
Définition | Connaître la définition, la signification, et la démarche étiologique devant une cécité monoculaire transitoire |
|
|
Définition | Connaître la définition d’une vascularite systémique |
|
|
Définition | Connaître les principaux types de vascularites systémiques |
|
|
Définition | Connaître les organes cibles de vascularites systémiques et les moyens diagnostiques |
|
|
Diagnostic positif | Savoir déterminer si un trouble visuel est mono- ou binoculaire |
|
|
Diagnostic positif | Savoir interpréter un réflexe photomoteur direct et consensuel (objectif commun avec item 81) |
|
|
Diagnostic positif | Savoir évoquer le diagnostic d’aura migraineuse, d’AIT, de crise épileptique partielle |
|
|
Diagnostic positif | Connaître les signes cliniques des affections vasculaires de la rétine (OACR, OVCR), leurs complications (néovascularisation, glaucome néovasculaire, œdème maculaire) et les principes de traitement |
|
|
Diagnostic positif | Connaître les diagnostics différentiels de l’aura migraineuse Décollement de rétine, glaucome, hémorragie du vitré |
|
|
Diagnostic positif | Connaître les signes cliniques d’une neuropathie optique (NOIA, NORB, œdème papillaire) |
|
|
Diagnostic positif | Connaître la présentation clinique, les modes de survenue, les facteurs de risque des décollements de rétine |
|
|
Diagnostic positif | Connaître les signes cliniques d’une hémorragie du vitré et ses principales causes, avec acuité visuelle, champ visuel, PEV, OCT |
|
|
Étiologies | Connaître les principales causes d’atteinte des voies optiques et du nerf optique et identifier les étiologies nécessitant une prise en charge urgente (NOIAA, œdème papillaire) |
|
|
Prise en charge | Connaître les principes de la prise en charge des vascularites |
|
|
Suivi et/ou pronostic | Connaître les principaux facteurs pronostiques des vascularites |
|
|
Examens complémentaires | Connaître les principaux examens complémentaires en ophtalmologie et leurs indications Atteinte du segment antérieur, du nerf optique (objectif commun avec item 81), de la rétine (AV, angiographie, OCT maculaire, ERG) |
|
|
Examens complémentaires | Indications de l’imagerie devant un trouble visuel récent |
|
|
Examens complémentaires | Connaître les principaux examens à réaliser en cas de suspicion de vascularite |
|
|
Contenu multimédia | Interpréter un réflexe photomoteur direct et consensuel (objectif commun avec item 81) |
|
|
Contenu multimédia | Photographie d’un œdème papillaire |
|
|
Contenu multimédia | Photographie d’un champ visuel des deux yeux avec hémianopsie (quadranopsie) latérale homonyme (ou bitemporale), y compris déficit pupillaire afférent relatif |
I Physiopathogénie
![]() La rétine est vascularisée par deux circulations différentes, alimentées toutes deux par des branches de l’artère ophtalmique branche collatérale de l’artère carotide interne (fig. 16.5) :
La rétine est vascularisée par deux circulations différentes, alimentées toutes deux par des branches de l’artère ophtalmique branche collatérale de l’artère carotide interne (fig. 16.5) :


La tomographie en cohérence optique-angiographie (OCT-A) montre les deux réseaux vasculaires rétiniens et choroïdiens représentés par des taches rouges surimposées sur la coupe de la macula.
Illustration de Carole Fumat.
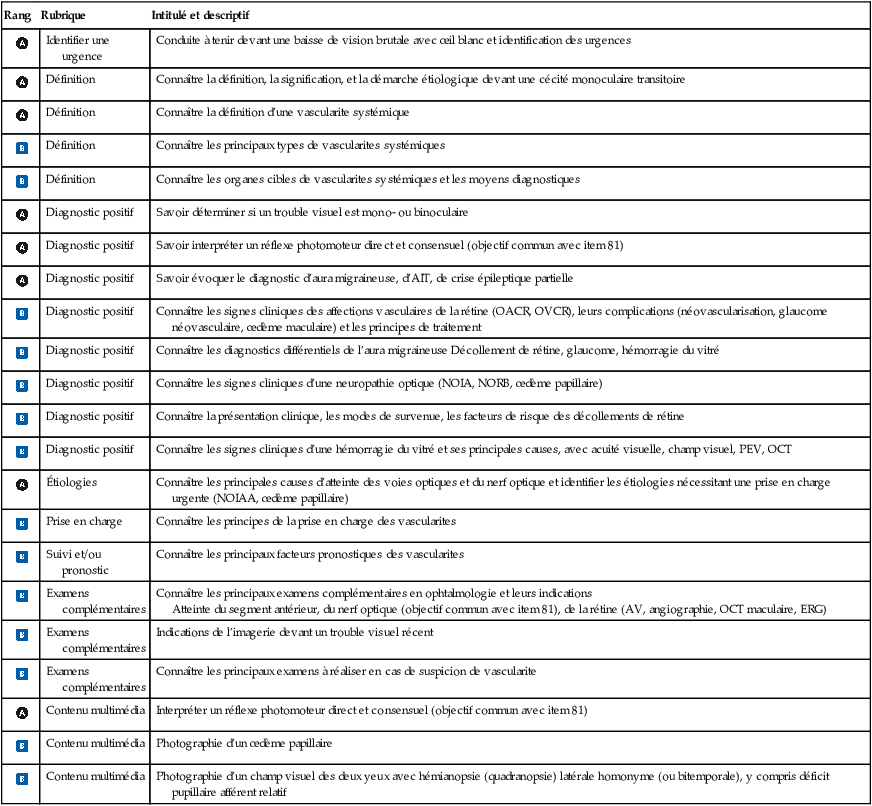
Ce schéma simplifié met en évidence les principaux éléments vasculaires associés à la rétine. À gauche, la veine et l’artère centrale de la rétine sont représentées en rouge et bleu, illustrant leur cheminement au sein du nerf optique. Juste à côté, le nerf optique apparaît en jaune avec sa trajectoire axiale, tandis que les gaines méningées sont indiquées par des traits parallèles en vert et violet. L’image, volontairement épurée, sert de légende graphique pour aider à la lecture anatomique des structures représentées dans une autre figure plus complète, mettant l’accent sur l’organisation des trajets vasculaires et méningés entourant le nerf optique.
- • la circulation choroïdienne est alimentée par les artères ciliaires postérieures, et assure la nutrition et l’oxygénation des couches externes (profondes) de la rétine, c’est-à-dire l’épithélium pigmentaire de la rétine et les photorécepteurs;
- • 288la circulation rétinienne proprement dite est issue de l’artère centrale de la rétine et vascu-larise les couches internes de la rétine, c’est-à-dire les cellules bipolaires, les cellules ganglionnaires et les axones des cellules ganglionnaires (fibres optiques);
- • l’artère centrale de la rétine se divise en deux branches supérieure et inférieure se divisant elles-mêmes, chacune, en branche temporale et branche nasale. La division se poursuit ensuite sur un mode dichotomique;
- • les artères ciliaires postérieures (ACP) sont la principale source de la vascularisation de la tête du nerf optique et de la choroïde. Les ACP sont, comme l’artère centrale de la rétine, des branches de l’artère ophtalmique, branche unique de la carotide interne (fig. 16.6).

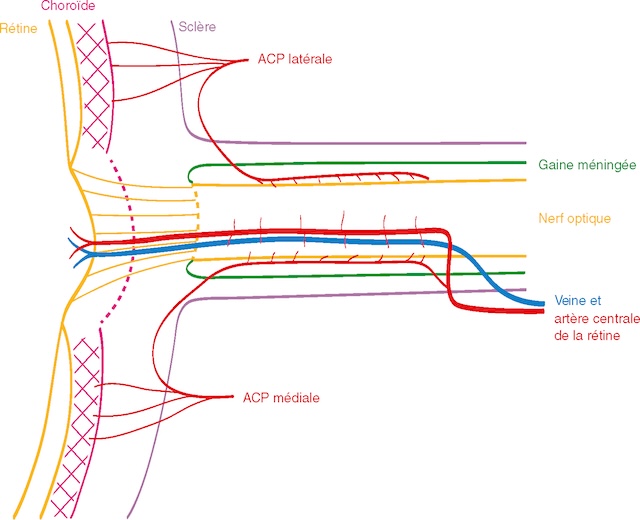
Fig. 16.6 Vascularisation du nerf optique.
ACP : artère ciliaire postérieure.
Illustration de Carole Fumat.Ce schéma en coupe sagittale illustre l’organisation vasculaire du nerf optique. On observe à gauche la choroïde en rose quadrillé et la sclère juste en avant. Deux artères ciliaires postérieures (ACP) sont indiquées : la latérale en rouge en haut et la médiale en rouge en bas, pénétrant la sclère pour irriguer la portion antérieure du nerf. Le nerf optique est représenté en jaune, entouré de gaines méningées vertes. Un vaisseau bleu et rouge, étiqueté comme veine et artère centrale de la rétine, traverse le nerf optique en son centre. Cette vascularisation est essentielle au bon fonctionnement visuel, illustrant l’interconnexion entre les structures intraoculaires et intracrâniennes.
![]() La vascularisation rétinienne est de type terminal, c’est-à-dire que tout le sang qui pénètre par l’artère centrale ressort de l’œil par la veine centrale de la rétine. Il n’y a pas d’anastomose possible avec une circulation de voisinage.
La vascularisation rétinienne est de type terminal, c’est-à-dire que tout le sang qui pénètre par l’artère centrale ressort de l’œil par la veine centrale de la rétine. Il n’y a pas d’anastomose possible avec une circulation de voisinage.
Lors de l’arrêt circulatoire dans le territoire de l’artère centrale de la rétine, les premières lésions ischémiques définitives de la rétine interne apparaissent dès 90 minutes et se poursuivent encore pendant une durée maximale de 6 heures. Par conséquent :
- • les occlusions artérielles rétiniennes entraînent souvent une perte d’acuité visuelle sévère de l’œil atteint malgré la mise en route d’un traitement en urgence;
- • les occlusions artérielles rétiniennes sont le plus souvent la traduction d’une atteinte vas-culaire sur l’axe carotidien ou d’une cardiopathie emboligène. Elles devront être l’occasion d’un bilan étiologique pour éviter qu’une urgence fonctionnelle visuelle ne se transforme en une urgence vitale.
289La neuropathie optique ischémique antérieure (NOIA) est due à une ischémie aiguë de la tête du nerf optique par occlusion des ACP ou de leurs branches.
II Occlusion de l’artère centrale de la rétine (OACR)
![]() L’occlusion de l’artère centrale de la rétine (OACR) est une pathologie rare; sa fréquence est estimée à une consultation sur 10 000. Les OACR atteignent le plus souvent des sujets autour de la soixantaine. L’accident n’est bilatéral que dans 1 % à 2 % des cas.
L’occlusion de l’artère centrale de la rétine (OACR) est une pathologie rare; sa fréquence est estimée à une consultation sur 10 000. Les OACR atteignent le plus souvent des sujets autour de la soixantaine. L’accident n’est bilatéral que dans 1 % à 2 % des cas.
A Diagnostic
![]() Les patients décrivent une baisse d’acuité visuelle brutale. Certains décrivent à l’interrogatoire un ou plusieurs épisodes antérieurs d’amaurose transitoire, témoin le plus souvent d’em-boles spontanément résolutifs, à partir d’une plaque d’athérome carotidien.
Les patients décrivent une baisse d’acuité visuelle brutale. Certains décrivent à l’interrogatoire un ou plusieurs épisodes antérieurs d’amaurose transitoire, témoin le plus souvent d’em-boles spontanément résolutifs, à partir d’une plaque d’athérome carotidien.
2 Examen
L’acuité visuelle est effondrée, le plus souvent limitée à une perception lumineuse. ![]() Toutes les cellules de transmission sont atteintes (cellules bipolaires et ganglionnaires), y compris celles connectées aux photorécepteurs de la macula.
Toutes les cellules de transmission sont atteintes (cellules bipolaires et ganglionnaires), y compris celles connectées aux photorécepteurs de la macula.
![]() Dès les premières minutes suivant l’occlusion artérielle, la pupille est en mydriase aréflective. Lors de l’éclairement de l’œil atteint, la voie afférente du RPM étant « supprimée » du fait de la baisse de vision, le RPM direct est aboli, mais également le RPM consensuel; Lors de l’éclai-rement de l’autre œil, à l’inverse, la voie afférente étant normale sur cet œil et la voie efférente étant normale sur les deux yeux, le RPM est conservé aux deux yeux.
Dès les premières minutes suivant l’occlusion artérielle, la pupille est en mydriase aréflective. Lors de l’éclairement de l’œil atteint, la voie afférente du RPM étant « supprimée » du fait de la baisse de vision, le RPM direct est aboli, mais également le RPM consensuel; Lors de l’éclai-rement de l’autre œil, à l’inverse, la voie afférente étant normale sur cet œil et la voie efférente étant normale sur les deux yeux, le RPM est conservé aux deux yeux.
3 Fond d’œil
Dans les tout premiers instants, la rétine peut avoir encore un aspect normal, mais il existe un rétrécissement diffus du calibre artériel et parfois un courant granuleux qui est plus facile à voir sur l’angiographie à la fluorescéine. Dans les heures qui suivent, un œdème ischémique rétinien, blanchâtre apparaît. Il traduit la souffrance ischémique des couches internes de la rétine. La fovéola, qui n’est pas masquée par l’œdème de la rétine interne, garde sa coloration normale et apparaît plus rouge par contraste avec tout le reste de la rétine ischémique (« tache rouge cerise de la macula »; fig. 16.7A).

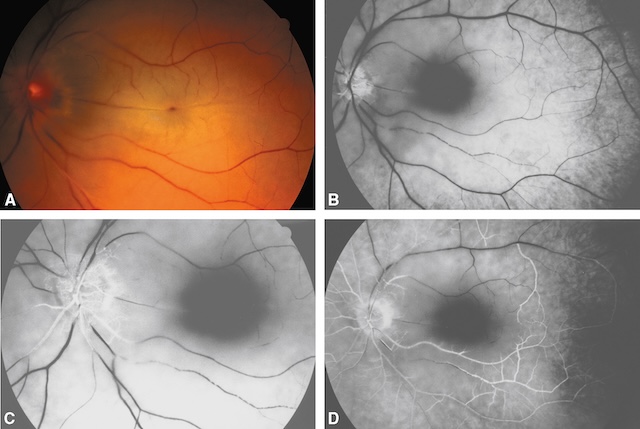
A. Cliché du fond d’œil. Rétine de coloration blanchâtre, sauf au niveau de la fovéola (tache rouge cerise de la macula). B-D. Angiographie fluorescéinique du fond d’œil : retard extrême de remplissage des branches de l’artère centrale de la rétine (B, C) avec courant granuleux, et allongement du temps de passage artérioveineux (D : il n’existe encore qu’un début de remplissage veineux plus de 6 minutes après l’injection de fluorescéine).
Cette série d’images montre les différentes phases d’exploration d’une occlusion de l’artère centrale de la rétine. En A, le fond d’œil couleur révèle un œdème rétinien pâle avec un macula en cerise centrale, reflet d’une ischémie aiguë. L’image B en angiographie précoce montre un retard net de remplissage artériel. L’image C confirme une absence de perfusion artérielle centrale, tandis que D met en évidence la persistance d’une perfusion veineuse périphérique partielle, contrastant avec la zone centrale sombre. L’ensemble illustre une ischémie rétinienne sévère avec atteinte du flux artériel principal.
4 Angiographie à la fluorescéine
![]() L’angiographie à la fluorescéine n’est pas indispensable au diagnostic et sa réalisation ne doit pas retarder la mise en route du traitement.
L’angiographie à la fluorescéine n’est pas indispensable au diagnostic et sa réalisation ne doit pas retarder la mise en route du traitement.
![]() L’angiographie à la fluorescéine est marquée par :
L’angiographie à la fluorescéine est marquée par :
- •
 un retard extrême de perfusion des branches de l’artère centrale de la rétine (fig. 16.7B,C);
un retard extrême de perfusion des branches de l’artère centrale de la rétine (fig. 16.7B,C); -
 le temps bras rétine normal est inférieur à 15 secondes (durée entre le moment d’injection de la fluorescéine au pli du coude et son arrivée dans l’artère centrale). Dans l’OACR, il peut atteindre plusieurs minutes;
le temps bras rétine normal est inférieur à 15 secondes (durée entre le moment d’injection de la fluorescéine au pli du coude et son arrivée dans l’artère centrale). Dans l’OACR, il peut atteindre plusieurs minutes; - •
 un allongement du temps de passage artérioveineux rétinien
un allongement du temps de passage artérioveineux rétinien  (temps entre l’arrivée de la fluorescéine dans l’artère centrale, son passage dans les capillaires et le retour veineux) qui normalement est inférieur à 3 secondes (fig. 16.3D).
(temps entre l’arrivée de la fluorescéine dans l’artère centrale, son passage dans les capillaires et le retour veineux) qui normalement est inférieur à 3 secondes (fig. 16.3D).
5 290Tomographie par cohérence optique
![]() II existe une hyperréflectivité des couches internes de la rétine qui sont le siège d’un œdème ischémique (fig. 16.8A) suivi d’une atrophie progressive (fig. 16.8B,C).
II existe une hyperréflectivité des couches internes de la rétine qui sont le siège d’un œdème ischémique (fig. 16.8A) suivi d’une atrophie progressive (fig. 16.8B,C).

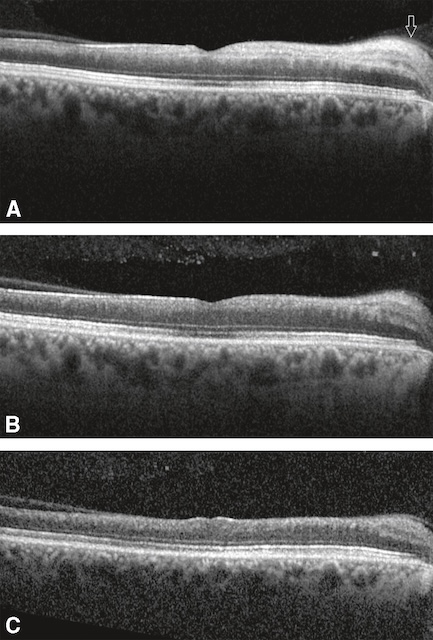
Il existe une hyperréflectivité des couches internes de la rétine (A, flèche) qui sont le siège d’un œdème isché-mique suivi d’une atrophie progressive (B, C).
Les trois coupes OCT présentées ici traversent la région maculaire. L’image A montre un discret épaississement de la rétine interne, avec un reflet altéré au niveau de l’interface vitréo-rétinienne. Sur B, la structure laminaire de la rétine apparaît mieux définie, avec une architecture relativement préservée, sans signes de liquide intrarétinien ni de décollement. La coupe C confirme l’intégrité des différentes couches rétiniennes, y compris la ligne de l’épithélium pigmentaire, sans anomalie notable. Ces séquences en B-scan sont typiques d’un contrôle OCT en absence de lésion exsudative ou œdémateuse.
B Étiologie
Le bilan étiologique sera d’autant plus exhaustif que le sujet est jeune.
On peut classer les causes dans plusieurs grandes classes selon le mécanisme en cause :
1 Embolies
Même quand un mécanisme embolique est fortement suspecté, un embole n’est pas nécessairement visible au fond d’œil. Dans d’autres cas, l’embole est parfaitement individualisable au fond d’œil.
Les pathologies emboligènes les plus fréquentes sont :
291Beaucoup plus rarement, il s’agit d’emboles lipidiques consécutifs à une fracture des os longs (« embolie graisseuse » se traduisant à l’examen du fond d’œil par des nodules cotonneux, fig. 16.9) ou d’emboles tumoraux (myxome de l’oreillette).

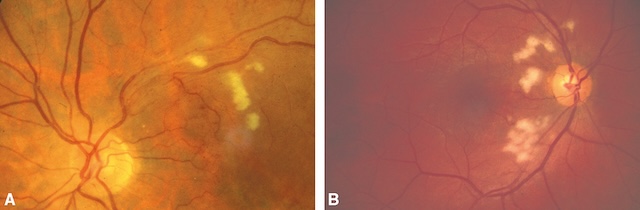
Lésions de petite taille, blanches, superficielles, d’aspect duveteux et à contours flous; chaque nodule correspond à une interruption du flux axoplasmique dans les fibres optiques secondaire à l’occlusion d’une artériole précapillaire. Il s’agit donc d’un signe d’ischémie localisée.
Ces deux photographies couleur du fond d’œil montrent plusieurs nodules cotonneux bien visibles, localisés à proximité de la papille optique. Sur l’image supérieure, les lésions blanches sont groupées en amas irréguliers le long des arcades vasculaires, contrastant nettement avec la rétine environnante. L’image inférieure confirme cette atteinte, avec des foyers cotonneux plus nombreux, éparpillés au-dessus et en dessous de la tête du nerf optique. L’aspect floconneux et blanchâtre de ces nodules traduit une ischémie focale des fibres nerveuses rétiniennes, fréquemment observée dans les rétinopathies hypertensives ou diabétiques.
2 292Thromboses
Les thromboses sont rencontrées dans l’artérite à cellules géantes (ACG, anciennement maladie de Horton) et les maladies de système.
L’artérite à cellules géantes est une urgence. Elle doit être recherchée systématiquement chez les sujets de plus de 50 ans, bien que 2 % seulement des cas se compliquent d’OACR, alors qu’il s’agit d’une cause plus fréquente de neuropathie optique ischémique antérieure (NOIA).
Les maladies de système sont plus occasionnelles. Il s’agit notamment du lupus érythémateux disséminé, de la granulomatose avec polyangéite (maladie de Wegener), de la maladie de Takayashu, de la maladie de Kawasaki, du syndrome de Churg-Strauss.
3 Troubles de la coagulation
Les troubles de la coagulation sont les mêmes que dans les occlusions veineuses rétiniennes (voir chapitre 17). Ils peuvent être liés à :
C Évolution spontanée
![]() L’évolution spontanée est presque toujours défavorable en l’absence d’une reperméabilisa-tion rapide; des lésions rétiniennes définitives apparaissent en effet après 90 minutes d’ischémie. Parfois, une récupération visuelle variable peut être observée lorsque l’ischémie rétinienne a été brève.
L’évolution spontanée est presque toujours défavorable en l’absence d’une reperméabilisa-tion rapide; des lésions rétiniennes définitives apparaissent en effet après 90 minutes d’ischémie. Parfois, une récupération visuelle variable peut être observée lorsque l’ischémie rétinienne a été brève.
![]() Dans la plupart des cas, l’œdème rétinien régresse sur une période allant de 4 à 6 semaines.
Dans la plupart des cas, l’œdème rétinien régresse sur une période allant de 4 à 6 semaines.
![]() Progressivement, la papille devient pâle, atrophique et les artères rétiniennes deviennent grêles, filiformes, les couches internes de la rétine s’atrophient. En l’absence de reperfusion, l’évolution vers un glaucome néovasculaire est possible
Progressivement, la papille devient pâle, atrophique et les artères rétiniennes deviennent grêles, filiformes, les couches internes de la rétine s’atrophient. En l’absence de reperfusion, l’évolution vers un glaucome néovasculaire est possible ![]() (comme dans une occlusion veineuse rétinienne ischémique non reperfusée).
(comme dans une occlusion veineuse rétinienne ischémique non reperfusée). ![]() Pour éviter l’évolution vers un glaucome néovasculaire, une destruction au laser des zones d’ischémie peut être indiquée.
Pour éviter l’évolution vers un glaucome néovasculaire, une destruction au laser des zones d’ischémie peut être indiquée.
D Conduite à tenir
L’OACR est une des rares véritables urgences en ophtalmologie. ![]() En effet, non seulement la fonction visuelle est menacée à très court terme, mais de plus cet accident peut être le témoin d’une pathologie systémique sous-jacente.
En effet, non seulement la fonction visuelle est menacée à très court terme, mais de plus cet accident peut être le témoin d’une pathologie systémique sous-jacente. ![]() Pour cette raison, le bilan étiologique et le traitement de l’occlusion artérielle doivent être menés dans le même temps, en urgence.
Pour cette raison, le bilan étiologique et le traitement de l’occlusion artérielle doivent être menés dans le même temps, en urgence.
1 Bilan étiologique
Il s’agit d’un accident vasculaire cérébral (AVC) et, à ce titre, le patient devrait être hospitalisé en urgence dans une unité neurovasculaire dans un objectif de prévention d’un autre événement vasculaire engageant le pronostic vital. ![]() En pratique, cette recommandation se heurte à la surcharge de ces centres spécialisés.
En pratique, cette recommandation se heurte à la surcharge de ces centres spécialisés.
293![]() Dans tous les cas, le bilan étiologique doit être réalisé rapidement. Il doit rechercher un athérome carotidien et une cardiopathie emboligène : la pratique de l’échographie cardiaque transœsophagienne est plus sensible pour retrouver une cause emboligène; la recherche d’une cause embolique curable est cruciale pour éviter la récidive d’emboles dans le territoire cérébral. Chez un sujet jeune, une dissection carotidienne doit également être recherchée (notion de traumatisme cervical).
Dans tous les cas, le bilan étiologique doit être réalisé rapidement. Il doit rechercher un athérome carotidien et une cardiopathie emboligène : la pratique de l’échographie cardiaque transœsophagienne est plus sensible pour retrouver une cause emboligène; la recherche d’une cause embolique curable est cruciale pour éviter la récidive d’emboles dans le territoire cérébral. Chez un sujet jeune, une dissection carotidienne doit également être recherchée (notion de traumatisme cervical).
Comme nous l’avons vu, l’artérite gigantocellulaire est rare, mais il faut systématiquement la rechercher sur des signes cliniques et paracliniques.
2 Traitement
Le traitement des OACR reste décevant. ![]() L’objectif de tous les traitements proposés est d’obtenir une reperméabilisation artérielle le plus tôt possible avant l’apparition de lésions rétiniennes ischémiques définitives, ce qui ne laisse que quelques heures après la survenue de l’accident.
L’objectif de tous les traitements proposés est d’obtenir une reperméabilisation artérielle le plus tôt possible avant l’apparition de lésions rétiniennes ischémiques définitives, ce qui ne laisse que quelques heures après la survenue de l’accident.
Le traitement fibrinolytique par voie intraveineuse ou par voie intra-artérielle par cathétérisme de l’artère ophtalmique n’a pas montré son efficacité.
![]() Un bilan cardiologique doit être demandé afin de rechercher une cardiopathie emboligène, une origine carotidienne.
Un bilan cardiologique doit être demandé afin de rechercher une cardiopathie emboligène, une origine carotidienne.
III Occlusion de branche de l’artère centrale de la rétine (OBACR)
Le tableau clinique est variable selon la localisation de l’occlusion, selon l’étendue du territoire ischémique et selon l’atteinte maculaire. L’atteinte maculaire conditionne le pronostic de cette affection.
Le début des signes fonctionnels est brutal et indolore. Les patients décrivent une amputation du champ visuel souvent à limite horizontale. Une baisse d’acuité visuelle s’observe dans les cas où la branche occluse vascularise la macula. L’examen du fond d’œil affirme le diagnostic en retrouvant un œdème rétinien ischémique en secteur localisé au territoire de la branche occluse.
![]() Il est important de préciser les rapports exacts avec la macula :
Il est important de préciser les rapports exacts avec la macula :
![]() Le site de l’obstruction se situe souvent au niveau d’une bifurcation artérielle et celle-ci est fréquemment soulignée par la présence d’un embole.
Le site de l’obstruction se situe souvent au niveau d’une bifurcation artérielle et celle-ci est fréquemment soulignée par la présence d’un embole.
2 Angiographie à la fluorescéine
L’angiographie à la fluorescéine n’est pas indispensable au diagnostic; elle permet de mieux préciser le degré et l’étendue de l’occlusion (fig. 16.10). L’occlusion de branche se manifeste par un retard de perfusion ou une absence complète de perfusion dans la branche occluse.

A. Branche supérieure. B. Branche ciliorétinienne.
Les deux clichés couleur du fond d’œil illustrent une occlusion de branche de l’artère centrale de la rétine. Sur l’image A, une zone rétinienne blanchâtre, bien délimitée, trahit une ischémie localisée dans le territoire vasculaire temporal supérieur. Cette pâleur contraste avec la coloration orangée normale du reste du fond d’œil. Sur l’image B, une atteinte similaire est visible dans le quadrant inférieur, avec un aspect d’œdème rétinien sectoriel. Dans les deux cas, la vascularisation rétinienne reste visible mais montre une interruption ou un affinement des branches artérielles correspondant aux zones ischémiques.
B 294Évolution
![]() Une reperméabilisation de la branche occluse en quelques jours est l’évolution habituelle.
Une reperméabilisation de la branche occluse en quelques jours est l’évolution habituelle. ![]() Après quelques semaines, on assiste à une résorption de l’œdème rétinien et à une remontée de l’acuité visuelle.
Après quelques semaines, on assiste à une résorption de l’œdème rétinien et à une remontée de l’acuité visuelle. ![]() Le pronostic visuel est bon, avec une acuité visuelle supérieure à 5/10es dans plus de 80 % des cas. L’amputation du champ visuel persiste en revanche à titre de séquelle.
Le pronostic visuel est bon, avec une acuité visuelle supérieure à 5/10es dans plus de 80 % des cas. L’amputation du champ visuel persiste en revanche à titre de séquelle.
C Étiologie
Les causes sont les mêmes que celles retrouvées dans les cas d’OACR (fig. 16.11), à l’exclusion de l’artérite gigantocellulaire ![]() (les branches de l’artère centrale de la rétine n’étant pas des artères musculaires, contrairement à l’artère centrale elle-même).
(les branches de l’artère centrale de la rétine n’étant pas des artères musculaires, contrairement à l’artère centrale elle-même).

A. Plusieurs emboles visibles à l’examen du fond d’œil (flèches). B. Angiographie fluorescéinique : absence de perfusion dans le territoire de l’artère occluse.
La première image montre une photographie couleur du fond d’œil centrée sur une branche artérielle temporale supérieure. Plusieurs emboles blanchâtres, bien visibles, sont alignés le long du trajet vasculaire, interrompant le flux sanguin artériel. Ces emboles apparaissent comme de petits dépôts ovalaires et brillants, traduisant une origine embolique, très probablement carotidienne. L’image B, en angiographie à la fluorescéine, confirme une absence de remplissage dans le segment vasculaire correspondant, avec une hypofluorescence nette de la zone rétinienne adjacente, secondaire à l’ischémie. Le reste de la vascularisation semble relativement épargné.
IV 295Neuropathie optique ischémique antérieure (NOIAA) aiguë
![]() La neuropathie optique ischémique non artéritique est la plus fréquente des neuropathies optiques ischémiques antérieures (NOIA) aiguë. La pathogenèse demeure mal connue. Un terrain cardiovasculaire est plus fréquemment retrouvé dans une « NOIA non artéritique » : hypertension artérielle, tabagisme, diabète, hypercholestérolémie, cardiopathie ischémique, pathologie vasculaire cérébrale, athéromatose carotidienne, migraine et apnée du sommeil. L’artérite à cellules géantes (anciennement maladie de Horton) dans la « NOIA artéritique » est une cause classique de NOIA, mais n’est de loin pas la plus fréquente des causes; elle nécessite un diagnostic et une prise en charge en urgence.
La neuropathie optique ischémique non artéritique est la plus fréquente des neuropathies optiques ischémiques antérieures (NOIA) aiguë. La pathogenèse demeure mal connue. Un terrain cardiovasculaire est plus fréquemment retrouvé dans une « NOIA non artéritique » : hypertension artérielle, tabagisme, diabète, hypercholestérolémie, cardiopathie ischémique, pathologie vasculaire cérébrale, athéromatose carotidienne, migraine et apnée du sommeil. L’artérite à cellules géantes (anciennement maladie de Horton) dans la « NOIA artéritique » est une cause classique de NOIA, mais n’est de loin pas la plus fréquente des causes; elle nécessite un diagnostic et une prise en charge en urgence.
B Diagnostic
Le diagnostic de NOIA est clinique.
2 Examen clinique
c Examen du fond d’œil
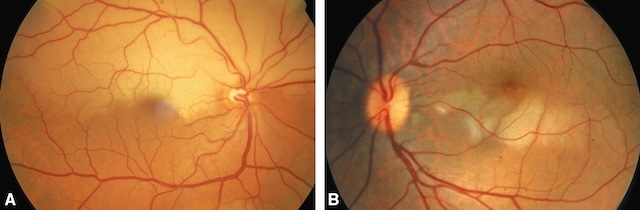
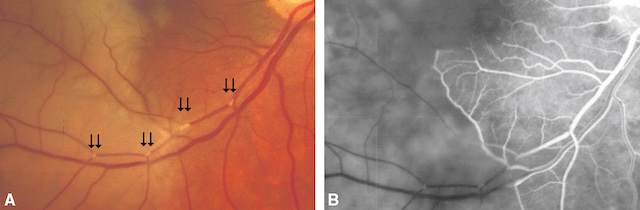
![]() L’œdème papillaire est le signe diagnostique initial le plus évident (fig. 16.12) et le plus important de la NOIA. Il peut ne toucher qu’un secteur ou être total, en fonction du territoire de l’ACP occluse; la papille a souvent une coloration pâle et il existe fréquemment une ou plusieurs hémorragies en flammèches sur le bord papillaire (fig. 16.13).
L’œdème papillaire est le signe diagnostique initial le plus évident (fig. 16.12) et le plus important de la NOIA. Il peut ne toucher qu’un secteur ou être total, en fonction du territoire de l’ACP occluse; la papille a souvent une coloration pâle et il existe fréquemment une ou plusieurs hémorragies en flammèches sur le bord papillaire (fig. 16.13).

L’image A montre une papille optique bien délimitée à droite, avec un contour net et une coloration physiologique, traduisant un aspect normal. L’arborescence vasculaire apparaît régulière, sans signe de congestion ni œdème. En revanche, l’image B révèle une papille à bords flous à gauche, signe typique d’un œdème papillaire. Cette anomalie est caractéristique d’une neuropathie optique ischémique antérieure. On observe un estompement global du disque optique, une hyperémie papillaire et une discrète opalescence adjacente, soulignant l’atteinte vasculaire aiguë du nerf optique.

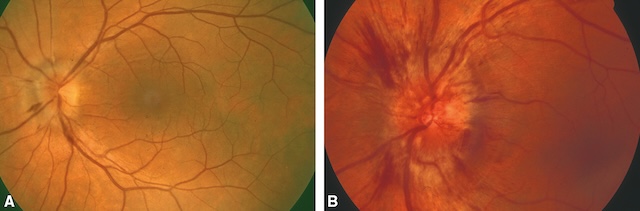
A. œdèmes papillaires associés à des hémorragies en flammèches localisées en nasal de la papille. B. œdèmes papillaires associés à des hémorragies en flammèches plus diffuses.
Sur l’image A, on distingue un disque optique pâle avec une atténuation du réseau vasculaire périphérique, traduisant une ischémie chronique. La papille montre une atrophie optique secondaire, sans signe inflammatoire aigu. En revanche, l’image B illustre une phase aiguë de neuropathie optique ischémique antérieure, avec un œdème papillaire important, des hémorragies en flammèche autour du nerf optique, et une hyperémie marquée. Les bords de la papille sont flous, envahis par l’œdème, témoignant d’une atteinte vasculaire brutale et sévère du nerf optique.
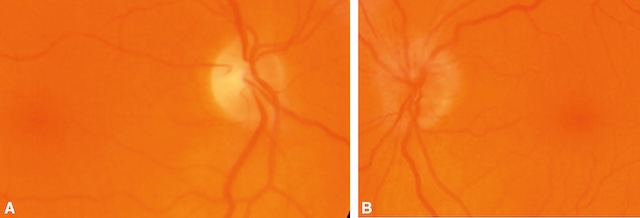
L’œdème papillaire est donc différent dans l’hypertension intracrânienne (fig. 16.14) où l’on observe un œdème papillaire bilatéral, avec une papille bien colorée, sans hémorragies et présence sur l’examen du champ visuel d’un simple élargissement des taches aveugles.

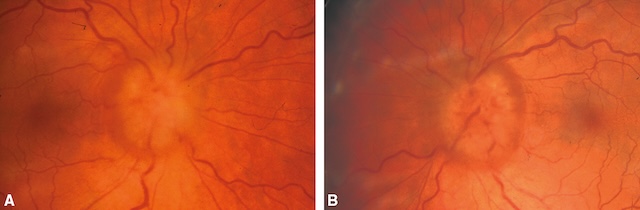
œdème papillaire bilatéral, papilles de coloration normale, absence d’hémorragies.
Les deux images révèlent un œdème papillaire massif avec des bords flous et surélevés, signe caractéristique d’une stase liée à une hypertension intracrânienne. Les vaisseaux rétiniens apparaissent tortueux et dilatés, engorgés par la pression accrue au niveau du nerf optique. Une hyperhémie papillaire est visible, renforçant l’aspect congestif de l’ensemble. Sur les deux clichés, l’aspect bombé et cotonneux du disque optique suggère une compression prolongée, altérant la transmission du signal visuel. Aucune hémorragie ou exsudat n’est notée, ce qui oriente vers une stase chronique plutôt que vers une neuropathie aiguë.
3 296Examens complémentaires
a Angiographie fluorescéinique du fond d’œil
L’angiographie du fond d’œil peut mettre en évidence des signes d’ischémie choroïdienne associée (fig. 16.15) qui sont en faveur d’une origine artéritique (dans le cadre d’une artérite gigantocellulaire : voir plus haut).

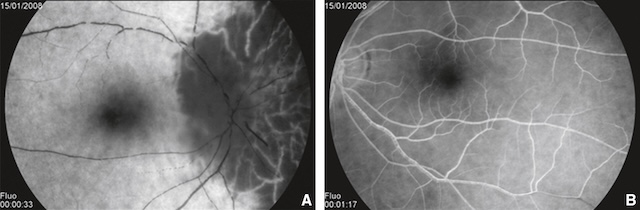
A. Large hypoperfusion choroïdienne sans aucune imprégnation de fluorescéine sur l’œil droit. B. Perfusion rétinienne et choroïdienne normale sur l’œil gauche.
Source : S. Milazzo†.
Sur ces deux clichés d’angiographie à la fluorescéine, on observe à l’image A un retard marqué de remplissage artériel au niveau de la tête du nerf optique, associé à une hypofluorescence segmentaire en temporal inférieur. Cette zone sombre indique une absence de perfusion liée à une ischémie sévère. L’image B, prise à un temps plus tardif, montre une diffusion limitée du colorant avec un contraste toujours anormalement faible autour de la papille. Le réseau capillaire périphérique apparaît intact, soulignant le caractère localisé de l’atteinte. Ces éléments traduisent une NOIA artéritique avec obstruction aiguë de la circulation ciliaire postérieure.
297En effet, comme évoqué plus haut, il existe une vascularisation conjointe de la choroïde et de la tête du nerf optique par les ACP. En cas d’artérite gigantocellulaire, l’atteinte est située en amont sur l’artère ophtalmique. Il en résulte un bas débit qui touche toutes les ACP avec une ischémie en aval, de la tête du nerf optique et de la choroïde. Dans la forme non artéritique, l’atteinte est plus localisée sur une ou plusieurs branches d’une ACP avec préservation globale de la vascularisation choroïdienne.
c Examen du champ visuel
Le champ visuel permet d’évaluer l’atteinte de la fonction visuelle de la NOIA. Le champ visuel retrouve typiquement un déficit fasciculaire (voir chapitre 1). Une limite horizontale du déficit du champ visuel (« déficit altitudinal ») est plus rare, mais plus spécifique d’une NOIA (fig. 16.16).

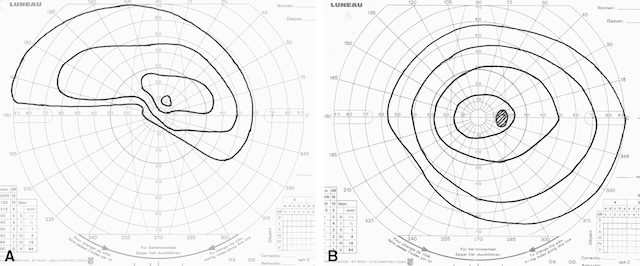
Déficit altitudinal inférieur, à limite horizontale, de l’œil gauche (champ visuel de l’œil droit normal). A. œil gauche. B. œil droit.
Sur ces deux tracés de périmétrie cinétique, on distingue des isoptères concentriques indiquant les limites de perception visuelle pour différents stimuli mobiles. L’image A montre une large amputation supérieure du champ visuel, avec une conservation centrale minime, traduisant un scotome altitudinal inférieur typique d’une neuropathie optique ischémique. En B, les isoptères apparaissent centrés et relativement réguliers, avec une atteinte modérée périphérique, laissant supposer un champ fonctionnel encore exploitable. La répartition des courbes témoigne d’une sensibilité rétinienne hétérogène, plus marquée au centre qu’en périphérie.
298Dans tous les cas, les déficits du champ visuel sont rattachés à la tache aveugle, ce qui traduit l’atteinte antérieure du nerf optique et permet d’orienter le diagnostic topographique.
C Diagnostic étiologique
1 Artérite à cellules géantes ou gigantocellulaire
![]() Il est essentiel de reconnaître la NOIA « artéritique » de cette vascularite granulomateuse à cellules géantes aussi précocement que possible pour instituer un traitement urgent du fait du risque très important de bilatéralisation, et donc de cécité bilatérale complète et définitive. Il faut rechercher systématiquement les arguments en faveur d’une artérite gigantocellulaire.
Il est essentiel de reconnaître la NOIA « artéritique » de cette vascularite granulomateuse à cellules géantes aussi précocement que possible pour instituer un traitement urgent du fait du risque très important de bilatéralisation, et donc de cécité bilatérale complète et définitive. Il faut rechercher systématiquement les arguments en faveur d’une artérite gigantocellulaire.
a Signes systémiques de la maladie
![]() Ces signes sont les suivants :
Ces signes sont les suivants :
- • la claudication intermittente de la mâchoire, particulièrement évocatrice;
- • l’atteinte rhumatismale des ceintures (« rhizomélique »);
- • l’hypersensibilité du cuir chevelu (« signe du peigne »);
- • les céphalées inhabituelles;
- • l’altération de l’état général;
- • la fièvre prolongée;
- • les modifications des artères temporales indurées à la palpation.
d Biopsie ou imagerie de l’artère temporale
- • La biopsie est la méthode diagnostique de référence pratiquée en cas de suspicion d’arté-rite gigantocellulaire pour infirmer ou confirmer le diagnostic, même si le tableau clinique est caractéristique.
- • Elle est pratiquée le plus tôt possible, mais elle ne doit pas retarder la corticothérapie qui ne la négative pas si elle est faite dans les 2 semaines.
- • Elle intéresse un long segment d’artère.
- • Elle est à refaire du côté opposé en cas de négativité de la première.
- • Elle met en évidence : la présence de cellules géantes, un épaississement de l’intima et une diminution de la taille de la lumière artérielle.
- • 299La confirmation histologique ou par imagerie est indispensable pour justifier la cortico-thérapie prolongée.
- • L’imagerie par échographie (épaississement hypo-échogène bilatéral des parois de l’artère temporale, « signe du halo ») ou par IRM peut confirmer à elle seule le diagnostic, mais sa négativité ne permet pas de l’infirmer. Dans ce dernier cas, on aura recours à la biopsie.
D Évolution
![]() L’œdème papillaire se résorbe habituellement spontanément et complètement en 6 à 8 semaines environ, laissant place à une atrophie optique en secteur ou totale, en fonction de l’étendue de l’œdème papillaire à la phase aiguë.
L’œdème papillaire se résorbe habituellement spontanément et complètement en 6 à 8 semaines environ, laissant place à une atrophie optique en secteur ou totale, en fonction de l’étendue de l’œdème papillaire à la phase aiguë.
Dans tous les cas, il ne faut pas espérer de récupération visuelle significative décours d’une NOIA.
La récidive est plus fréquente sur l’autre œil que sur le même œil. Cette bilatéralisation est plus fréquente chez les patients atteints d’artérite gigantocellulaire et peut survenir en seulement quelques jours voire quelques heures, justifiant l’urgence de la mise en route d’une corticothérapie.
E Diagnostic différentiel
![]() Le diagnostic de NOIA est habituellement simple; il est clinique. L’important est surtout de reconnaître l’artérite gigantocellulaire pour une prise en charge précoce.
Le diagnostic de NOIA est habituellement simple; il est clinique. L’important est surtout de reconnaître l’artérite gigantocellulaire pour une prise en charge précoce.
Le diagnostic différentiel comprend les autres causes d’œdème papillaire, notamment l’hypertension intracrânienne (HIC). Dans ce dernier cas, il s’agit souvent d’un œdème papillaire bilatéral sans altération de la vision en début d’évolution. Seul un élargissement des taches aveugles peut être observé dès le début d’une HIC.
F Traitement
![]() Devant toute suspicion d’artérite gigantocellulaire réalisant la NOIA artéritique avec ou sans baisse d’acuité visuelle, il faut commencer la corticothérapie générale immédiatement, avant même de réaliser la biopsie de l’artère temporale pour éviter une aggravation de l’œil atteint ou une bilatéralisation. Une dose initiale de prednisone comprise entre 0,7 et 1 mg/kg est le plus souvent suffisante pour rendre l’inflammation quiescente. Des perfusions (« bolus ») de méthy-prednisolone sur 1 à 3 jours peuvent précéder la corticothérapie per os. Leur efficacité est à ce jour discutée. Une prescription d’aspirine à dose antiagrégante plaquettaire est classiquement associée. La corticothérapie est ensuite diminuée rapidement le premier mois, puis lentement après une durée totale de 12 mois en fonction de la clinique, de la VS et de la CRP.
Devant toute suspicion d’artérite gigantocellulaire réalisant la NOIA artéritique avec ou sans baisse d’acuité visuelle, il faut commencer la corticothérapie générale immédiatement, avant même de réaliser la biopsie de l’artère temporale pour éviter une aggravation de l’œil atteint ou une bilatéralisation. Une dose initiale de prednisone comprise entre 0,7 et 1 mg/kg est le plus souvent suffisante pour rendre l’inflammation quiescente. Des perfusions (« bolus ») de méthy-prednisolone sur 1 à 3 jours peuvent précéder la corticothérapie per os. Leur efficacité est à ce jour discutée. Une prescription d’aspirine à dose antiagrégante plaquettaire est classiquement associée. La corticothérapie est ensuite diminuée rapidement le premier mois, puis lentement après une durée totale de 12 mois en fonction de la clinique, de la VS et de la CRP.
En cas de corticodépendance, de haut risque de complications ou d’échec de sevrage de la corticothérapie à 12 mois, des thérapies immunosuppressives ou ciblées (tocilizumab) peuvent être discutées en deuxième intention. Dans la NOIA non artéritique, aucun traitement n’a démontré son efficacité. Il se résume à la prise en charge des facteurs de risque identifiés afin de réduire le risque de bilatéralisation.
Remerciements. Le COUF remercie le Collège de neurologie pour sa relecture.
 Compléments en ligne
Compléments en ligne
À propos de l’artérite gigantocellulaire et de ses atteintes ophtalmologiques :
- A C’est une cause classique d’occlusion de branche de l’artère centrale de la rétine
- B Il s’agit de la première cause de neuropathie optique ischémique antérieure aiguë
- C L’occlusion de l’artère centrale de la rétine est observée dans 80 % des cas
- D L’instauration d’une corticothérapie IV permet une restitution ad integrum de l’acuité visuelle d’un œil atteint de neuropathie optique ischémique antérieure aiguë
- E En cas d’atteinte ophtalmologique, elle constitue une urgence thérapeutique
Parmi les affirmations suivantes relatives à l’occlusion de l’artère centrale de la rétine (OACR), laquelle est exacte ?
Comment se nomment les deux circulations qui assurent la vascularisation de la rétine ?
À propos des atteintes vasculaires rétiniennes, laquelle (lesquelles) des propositions suivantes est (sont) exacte(s) ?
- A Les nodules cotonneux signent le caractère ischémique
- B L’atteinte maculaire conditionne le pronostic visuel
- C Les embolies graisseuses peuvent être à l’origine de nodules cotonneux
- D Une occlusion veineuse rétinienne peut être responsable de nodules cotonneux
- E Une occlusion de branche de l’artère centrale de la rétine ne se reperfuse jamais
À propos des signes et symptômes de neuropathie optique ischémique antérieure (NOIA), quelles sont les propositions exactes ?
- A Un déficit pupillaire afférent relatif est attendu
- B La baisse d’acuité visuelle est lentement progressive
- C Une récupération totale de l’acuité visuelle est la règle après 6 semaines d’évolution
- D Elle s’accompagne de douleur à la mobilisation du globe
- E Un ou des épisode(s) d’amaurose transitoire précèdent fréquemment une NOIA
Quels signes cliniques sont retrouvés au fond d’œil d’un patient atteint de NOIA (unilatérale) ?
Quel examen complémentaire est nécessaire au diagnostic de NOIA ?
À propos d’une NOIA artéritique, quelles sont les propositions vraies ?
