CHAPITRE 7: Item 81 Altération chronique de la vision
Situations cliniques de départ
Une altération chronique de la fonction visuelle peut être évoquée dans les situations cliniques suivantes.
 27 – Chute de la personne âgée : une altération chronique de la fonction visuelle est une cause fréquente de chute chez la personne âgée. Les principales étiologies à rechercher sont les suivantes : cataracte, glaucome chronique et DMLA. Enfin, il ne faut pas méconnaître les troubles du champ visuel pouvant survenir après un accident vasculaire cérébral.
27 – Chute de la personne âgée : une altération chronique de la fonction visuelle est une cause fréquente de chute chez la personne âgée. Les principales étiologies à rechercher sont les suivantes : cataracte, glaucome chronique et DMLA. Enfin, il ne faut pas méconnaître les troubles du champ visuel pouvant survenir après un accident vasculaire cérébral.
 138 – Anomalie de la vision : une altération chronique de la fonction visuelle peut se manifester de différentes manières, avec baisse de l’acuité visuelle, métamorphopsie, scotome, altération du champ visuel périphérique, altération de la vision des couleurs, etc. Il convient donc de ne pas tester le patient uniquement sur son acuité visuelle.
138 – Anomalie de la vision : une altération chronique de la fonction visuelle peut se manifester de différentes manières, avec baisse de l’acuité visuelle, métamorphopsie, scotome, altération du champ visuel périphérique, altération de la vision des couleurs, etc. Il convient donc de ne pas tester le patient uniquement sur son acuité visuelle.
 316 – Identifier les conséquences d’une pathologie/situation sur le maintien d’un emploi : certains métiers nécessitent une vision fine et précise (chauffeur routier, contrôleur aérien, etc.), ou une amplitude de champ visuel minimale. Ainsi, une altération chronique dégénérative de la vision peut être contre-indiquée pour l’exercice de certains métiers.
316 – Identifier les conséquences d’une pathologie/situation sur le maintien d’un emploi : certains métiers nécessitent une vision fine et précise (chauffeur routier, contrôleur aérien, etc.), ou une amplitude de champ visuel minimale. Ainsi, une altération chronique dégénérative de la vision peut être contre-indiquée pour l’exercice de certains métiers.
 328 – Annonce d’une maladie chronique : le dépistage d’une maladie provoquant une altération chronique de la vision doit être annoncé de manière claire, précise et intelligible pour le patient. En effet, certaines de ces affections requièrent des soins fréquents (injections intravitréennes, traitement topique journalier, etc.) et l’adhésion du patient à ce traitement nécessite une compréhension des risques encourus par la maladie.
328 – Annonce d’une maladie chronique : le dépistage d’une maladie provoquant une altération chronique de la vision doit être annoncé de manière claire, précise et intelligible pour le patient. En effet, certaines de ces affections requièrent des soins fréquents (injections intravitréennes, traitement topique journalier, etc.) et l’adhésion du patient à ce traitement nécessite une compréhension des risques encourus par la maladie.
 345 – Situation de handicap : de nombreuses altérations chroniques de la vision peuvent évoluer vers une situation de handicap, nécessitant des aides particulières (adaptation du plan de travail, tierce personne, aide à domicile, etc.).
345 – Situation de handicap : de nombreuses altérations chroniques de la vision peuvent évoluer vers une situation de handicap, nécessitant des aides particulières (adaptation du plan de travail, tierce personne, aide à domicile, etc.).
Hiérarchisation des connaissances
| Rang | Rubrique | Intitulé et descriptifs |
|
|
Prévalence, épidémiologie | Connaître l’épidémiologie de la DMLA |
|
|
Prévalence, épidémiologie | Connaître l’épidémiologie de la cataracte |
|
|
Définition | Connaître la définition de la DMLA* |
|
|
Définition | Connaître la définition de la cataracte, ses principales causes et les modalités de diagnostic clinique |
|
|
Définition | Connaître la définition du glaucome primitif à angle ouvert |
| A | Diagnostic positif | Savoir interpréter un réflexe photomoteur direct et consensuel (objectif commun avec item 82)* |
|
|
Diagnostic positif | Connaître la séméiologie et les moyens de dépistage d’un syndrome maculaire |
|
|
Diagnostic positif | Connaître la séméiologie et les moyens de dépistage d’un syndrome maculaire |
|
|
Diagnostic positif | Connaître les pathologies maculaires chroniques hors DMLA (membrane épirétinienne, trou maculaire, œdème maculaire) |
|
|
Diagnostic positif | Connaître les principales caractéristiques de l’atteinte du glaucome primitif à angle ouvert : structure et fonction |
|
|
Étiologies | Connaître les principales étiologies d’altération chronique de la vision Interrogatoire et examen clinique |
|
|
Étiologies | Connaître les grandes familles médicamenteuses à l’origine d’une altération chronique de la vision Atteinte de la rétine, du cristallin ou du nerf optique |
|
|
Prise en charge | Savoir que le traitement du glaucome primitif à angle ouvert est la réduction de la PIO |
|
|
Prise en charge | Conduite automobile et handicap |
|
|
Examens complémentaires | Connaître les principaux examens complémentaires en ophtalmologie et leurs indications Atteinte du segment antérieur, du nerf optique (objectif commun avec item 80), de la rétine (AV, angiographie, OCT maculaire, ERG) |
|
|
Contenu multimédia | Savoir interpréter un réflexe photomoteur direct et consensuel (objectif commun avec item 82)* |
149![]() Les traumatismes étant traités par ailleurs, ne seront abordées ici que les altérations non traumatiques de la fonction visuelle.
Les traumatismes étant traités par ailleurs, ne seront abordées ici que les altérations non traumatiques de la fonction visuelle.
L’étudiant se reportera au chapitre 1 pour les notions concernant l’anatomie de l’œil et des voies visuelles, la physiologie de la vision et les méthodes d’examen.
I Introduction
![]() La fonction visuelle associe l’acuité visuelle (AV) et le champ visuel. Alors que l’AV mesure uniquement l’intégrité de l’axe visuel central, c’est-à-dire ce que le patient voit en face de lui, le champ visuel étudie le reste de la vision, c’est-à-dire ce que le patient voit en périphérie. Deux seuils de vision sont définis légalement : une AV < 1/20e qui établit le seuil de cécité légale selon l’Organisation mondiale de la santé (OMS); une AV d’aptitude à la conduite
La fonction visuelle associe l’acuité visuelle (AV) et le champ visuel. Alors que l’AV mesure uniquement l’intégrité de l’axe visuel central, c’est-à-dire ce que le patient voit en face de lui, le champ visuel étudie le reste de la vision, c’est-à-dire ce que le patient voit en périphérie. Deux seuils de vision sont définis légalement : une AV < 1/20e qui établit le seuil de cécité légale selon l’Organisation mondiale de la santé (OMS); une AV d’aptitude à la conduite ![]() d’au minimum 5/10es pour la conduite automobile en France, et au moins 8/10es pour l’œil le meilleur et 1/10e pour l’œil le moins bon pour l’aptitude poids lourd,
d’au minimum 5/10es pour la conduite automobile en France, et au moins 8/10es pour l’œil le meilleur et 1/10e pour l’œil le moins bon pour l’aptitude poids lourd, ![]() en plus de seuils spécifiques de champ visuel. L’objectif de ce chapitre est de montrer comment mener la démarche diagnostique pour expliquer une altération chronique de la vision.
en plus de seuils spécifiques de champ visuel. L’objectif de ce chapitre est de montrer comment mener la démarche diagnostique pour expliquer une altération chronique de la vision.
II Examen
Les objectifs de l’interrogatoire sont de :
- • préciser le type d’altération visuelle et les symptômes associés :
- – une baisse objective de l’acuité visuelle, chiffrée sur une échelle de lecture de type Snellen qui explore l’intégrité et le fonctionnement des structures dans l’axe visuel dont la rétine maculaire,
- – une altération du champ visuel. Dépistée grossièrement au doigt, elle est objectivée par l’examen périmétrique qui met en évidence un déficit de sensibilité de la rétine périphérique. Ce déficit peut être unilatéral (scotome) ou bilatéral (quadra- ou hémianopsies),
- – des métamorphopsies (vision déformée des objets avec des lignes droites qui apparaissent ondulées) pouvant être dépistées par la grille d’Amsler,
- – des macropsies ou micropsies (impression de grossissement ou de rétrécissement des images),
- – une dyschromatopsie (modification de la vision des couleurs) pouvant être objectivée par un test de la vision des couleurs,
- – une photophobie (éblouissement important à la lumière),
- – une diminution de la sensibilité aux contrastes,
- – 150
 la présence de myodésopsies (sensation de « mouches volantes »),
la présence de myodésopsies (sensation de « mouches volantes »), - – la présence de phosphènes (éclairs lumineux),
- – une éclipse visuelle brève (disparition totale de la vision, quelques secondes, souvent bilatérale déclenchée par les mouvements de la tête ou les efforts),
- – une cécité monoculaire transitoire (disparition totale de la vision, pendant quelques minutes à quelques heures, spontanément résolutive),
- – une aura visuelle (flashs colorés accompagnés d’un scotome scintillant s’étendant progressivement à un hémichamp visuel précédant ou non une migraine);
- • déterminer son mode d’installation : ces symptômes sont-ils apparus brutalement ou progressivement sur plusieurs heures/jours/semaines ?
- • caractériser son caractère uni- ou bilatéral;
- • préciser la présence ou non de douleurs associées et leur type :
- – douleurs superficielles, évoquant une affection du segment antérieur (kératite, corps étranger cornéen, etc.),
- – douleurs profondes, irradiant dans le territoire du nerf trijumeau, pouvant faire évoquer une crise de glaucome aigu,
- – céphalées « vraies », évoquant une étiologie neuro-ophtalmologique;
- • rechercher des antécédents oculaires et généraux;
- • préciser les traitements oculaires et généraux en cours ou récemment arrêtés;
- • rechercher une notion de traumatisme, même minime.
B Examen ophtalmologique
L’examen est toujours bilatéral et comparatif, et comprend de manière systématique :
- • la mesure de l’acuité visuelle de loin et de près, avec correction optique si nécessaire;
- • la réactivité pupillaire : réflexe photomoteur direct et réflexe photomoteur consensuel à l’éclairement de l’œil controlatéral (voir chapitre 1);
- • l’examen du segment antérieur au biomicroscope : cornée, chambre antérieure et cristallin;
- • la mesure du tonus oculaire (tonomètre à air pulsé ou à aplanation);
- • l’examen après dilatation pupillaire : cristallin, vitré, rétine, vaisseaux rétiniens, nerf optique.
C Examens complémentaires
![]() Les examens complémentaires ne sont pas systématiques et sont orientés en fonction de l’interrogatoire et de l’examen clinique approfondi.
Les examens complémentaires ne sont pas systématiques et sont orientés en fonction de l’interrogatoire et de l’examen clinique approfondi.
Les examens complémentaires strictement « ophtalmologiques » (OCT, angiographies, ERG, PEV, etc.) sont détaillés dans le chapitre 1.
![]() Les examens complémentaires systémiques (biologie, radiographies, imagerie orbito-cérébrale, etc.) seront demandés en fonction des orientations diagnostiques à l’issue de l’interrogatoire et de l’examen clinique et, au besoin, après avis de collègues d’autres spécialités (neurologues, internistes, rhumatologues, etc.).
Les examens complémentaires systémiques (biologie, radiographies, imagerie orbito-cérébrale, etc.) seront demandés en fonction des orientations diagnostiques à l’issue de l’interrogatoire et de l’examen clinique et, au besoin, après avis de collègues d’autres spécialités (neurologues, internistes, rhumatologues, etc.).
D Démarche diagnostique
![]() À l’issue de l’examen complet initial, l’altération de la fonction visuelle peut apparaître comme « brutale » ou « progressive ». Généralement, la première étape consiste à identifier 151le type d’altération visuelle : baisse d’acuité visuelle qui est associée à une atteinte de l’axe optique, ou trouble du champ visuel qui est plutôt associé à une atteinte périphérique ou du nerf optique. La démarche diagnostique dépendra ensuite des éléments anormaux mis en évidence lors des examens cliniques et complémentaires.
À l’issue de l’examen complet initial, l’altération de la fonction visuelle peut apparaître comme « brutale » ou « progressive ». Généralement, la première étape consiste à identifier 151le type d’altération visuelle : baisse d’acuité visuelle qui est associée à une atteinte de l’axe optique, ou trouble du champ visuel qui est plutôt associé à une atteinte périphérique ou du nerf optique. La démarche diagnostique dépendra ensuite des éléments anormaux mis en évidence lors des examens cliniques et complémentaires.
III Baisse d’acuité visuelle brutale
![]() Les anomalies de la vision d’apparition brutale sont traitées au chapitre 8.
Les anomalies de la vision d’apparition brutale sont traitées au chapitre 8.
IV Baisse d’acuité visuelle progressive
![]() La démarche diagnostique et les examens complémentaires associés sont résumés dans la figure 7.1.
La démarche diagnostique et les examens complémentaires associés sont résumés dans la figure 7.1.

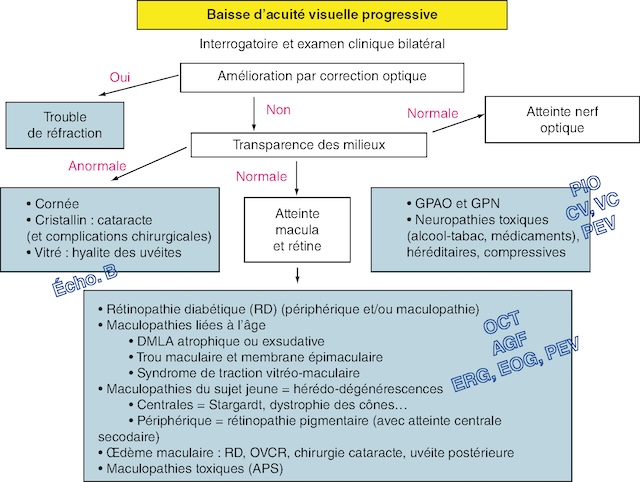
AGF : angiographie à la fluorescéine; APS : antipaludéens de synthèse; CV : champ visuel; EOG : électro-oculogramme; ERG : électrorétinogramme; GCAO : glaucome chronique à angle ouvert; GPN : glaucome à pression normale; PEV : potentiels évoqués visuels; VC : vision des couleurs; PIO : pression intraoculaire.
Voici une organigramme qui présente la démarche diagnostique face à une baisse progressive de l’acuité visuelle, débutant par un examen clinique bilatéral. Avec une correction optique, un trouble de réfraction est suspecté si l’acuité visuelle s’améliore. En l’absence d’amélioration, la transparence des milieux oculaires est évaluée. Une transparence anormale pointe vers une atteinte de la cornée, du cristallin (exemple : cataracte), ou du vitré (exemple : hyalite des uvéites). Si la transparence des milieux est normale, une atteinte de la macula ou de la rétine est envisagée, qui pointe vers la rétinopathie diabétique, les maculopathies liées à l’âge (exemple : DMLA atrophiée ou exsudative, trou maculaire et membrane épimaculaire, syndrome de traction vitreo-maculaire), l'œderme maculaire (exemple : RD, OVCR, chirurgie cataracte, uvéite postérieure) et les maculopathies toxiques (exemple : APS). Chez les sujets jeunes, les maculopathies sont généralement liées à des hérédo-dégénérescences centrales (exemple : maladie de Stargardt, dystrophie des cones) et périphériques (exemple : retinopathie pigmentaire). Les examens complémentaires mentionnés incluent l’échographie (Écho. B), OCT, AGF, ERG, EOG, et PEV. Les abréviations GPAO, GPN, CV, VC, et PIO sont associées aux atteintes du nerf optique.
A 152Cataracte
![]() Voir chapitre 13.
Voir chapitre 13.
La cataracte se manifeste par une baisse d’acuité visuelle progressive, bilatérale, parfois légèrement asymétrique, une photophobie (éblouissement par les phares lors de la conduite automobile la nuit, etc.), une myopie d’indice (diminution du besoin de porter les verres correcteurs en vision de près) et/ou une diplopie monoculaire (cataracte nucléaire).
L’examen après dilatation pupillaire objective une perte de la transparence cristallinienne avec un aspect opalescent marqué, parfois une coloration brun-jaunâtre du cristallin. En fonction des patients et de la topographie de l’opacification, la cataracte peut être « nucléaire » (centrale), « corticale » (périphérique) ou limitée à la face postérieure du cristallin et alors qualifiée de « sous-capsulaire postérieure ». La principale étiologie des cataractes reste l’âge; on parle de cataracte « sénile », ![]() mais d’autres étiologies sont possibles telles que les cataractes iatro-gènes secondaires à la prise de corticoïdes locaux ou généraux au long cours. Dans ce cas, elles prennent généralement une forme sous-capsulaire postérieure.
mais d’autres étiologies sont possibles telles que les cataractes iatro-gènes secondaires à la prise de corticoïdes locaux ou généraux au long cours. Dans ce cas, elles prennent généralement une forme sous-capsulaire postérieure.
B Glaucome chronique à angle ouvert
![]() Voir chapitre 14.
Voir chapitre 14.
La principale difficulté diagnostique du glaucome chronique à angle ouvert réside dans son caractère longtemps asymptomatique (contrairement au glaucome aigu par fermeture d’angle [GAFA]). ![]() Il entraîne des altérations progressives du champ visuel périphérique sans baisse d’acuité visuelle associée, celle-ci ne survenant qu’aux stades les plus tardifs de l’affection. Le glaucome chronique à angle ouvert est souvent bilatéral.
Il entraîne des altérations progressives du champ visuel périphérique sans baisse d’acuité visuelle associée, celle-ci ne survenant qu’aux stades les plus tardifs de l’affection. Le glaucome chronique à angle ouvert est souvent bilatéral.
Le diagnostic repose sur l’analyse conjointe des trois critères suivants :
![]() Le traitement repose sur l’instillation au long cours de collyres hypotonisants (visant selon les classes pharmacologiques à diminuer la sécrétion d’humeur aqueuse ou à augmenter sa résorption), la trabéculoplastie au laser ou la chirurgie (sclérectomie profonde, trabéculectomie).
Le traitement repose sur l’instillation au long cours de collyres hypotonisants (visant selon les classes pharmacologiques à diminuer la sécrétion d’humeur aqueuse ou à augmenter sa résorption), la trabéculoplastie au laser ou la chirurgie (sclérectomie profonde, trabéculectomie).
C Affections rétiniennes
1 Dystrophies rétiniennes héréditaires
![]() Les dystrophies rétiniennes héréditaires sont des affections rétiniennes dégénératives qui affectent le plus souvent les photorécepteurs et/ou l’épithélium pigmentaire, pouvant toucher des individus de tous âges, selon un mode de transmission variable (autosomique dominant, récessif, lié à l’X, cas isolés, etc.). Dans certains cas, la dystrophie rétinienne peut être syndro-mique et être associée à d’autres atteintes systémiques.
Les dystrophies rétiniennes héréditaires sont des affections rétiniennes dégénératives qui affectent le plus souvent les photorécepteurs et/ou l’épithélium pigmentaire, pouvant toucher des individus de tous âges, selon un mode de transmission variable (autosomique dominant, récessif, lié à l’X, cas isolés, etc.). Dans certains cas, la dystrophie rétinienne peut être syndro-mique et être associée à d’autres atteintes systémiques.
Elles sont le plus souvent bilatérales et schématiquement de deux types : maculaires (avec une atteinte prédominante des cônes) ou périphériques (avec une atteinte prédominante des bâtonnets), mais elles peuvent aussi atteindre l’ensemble de la rétine (atteinte des cônes et des bâtonnets).
a Maculopathies héréditaires
La plus fréquente est la maladie de Stargardt. Il s’agit d’une affection autosomique récessive, débutant dans l’enfance (vers 7-12 ans) et responsable d’une baisse progressive et bilatérale 153de l’acuité visuelle pouvant être très sévère (1/20e à 1/10e en fin d’évolution). Elle se traduit à l’examen du fond d’œil par des remaniements maculaires donnant un aspect typique de « maculopathie en œil de bœuf », analogue à l’aspect observé dans la maculopathie aux antipaludéens de synthèse (voir ci-dessous « Maculopathies toxiques aux antipaludéens de synthèse »).
D’autres affections maculaires héréditaires moins fréquentes existent comme la maladie de Best (autosomique dominante), la dystrophie des cônes, etc.
b Dystrophies rétiniennes héréditaires périphériques : les rétinopathies pigmentaires
Il s’agit d’un groupe d’affections caractérisé par la dégénérescence progressive des photorécepteurs (bâtonnets initialement suivis parfois des cônes), liée à des altérations génétiques variables (plus de 200 mutations affectant des protéines impliquées dans la cascade de photo-transduction peuvent donner le même phénotype). Le mode de transmission est variable d’une famille à une autre; 30 à 40 000 personnes sont concernées en France.
L’atteinte principalement des bâtonnets est responsable d’une héméralopie (gêne en vision crépusculaire et nocturne) et d’un rétrécissement progressif du champ visuel débutant dans l’enfance. Aux stades les plus évolués, il ne persiste qu’un champ visuel tubulaire, correspondant à la perte complète des bâtonnets périphériques et à la seule persistance des cônes centraux. Parfois, l’atteinte secondaire des cônes peut conduire à la cécité complète.
Le terme « rétinopathie pigmentaire » vient de l’aspect de la rétine au fond d’œil qui présente des migrations de pigments sous-rétiniens donnant dans les formes typiques un aspect réticulé dit en « pseudo-ostéoblastes », car rappelant l’organisation des ostéoblastes sur les lames histologiques (fig. 7.2 et fig. 7.3).

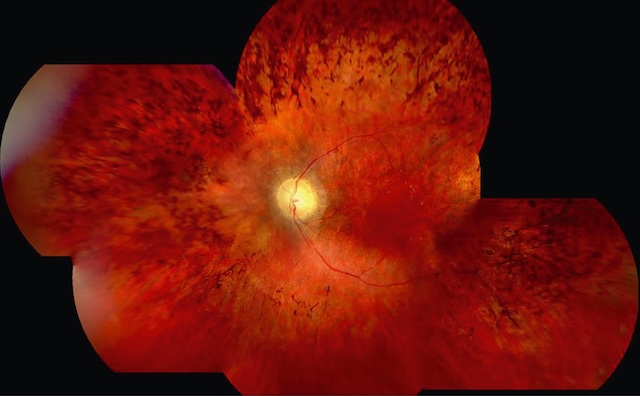
Souvent, un aspect grêle des vaisseaux rétiniens ainsi qu’une pâleur cireuse du nerf optique sont associés. Noter la présence de nombreux pseudo-ostéoblastes périphériques.
Photographie couleur composite du fond d’œil montrant une papille optique centrale pâle entourée d’une rétine de teinte rouge-orangé. La périphérie rétinienne présente des migrations pigmentaires sous forme de dépôts en « pseudo-ostéoblastes », caractéristiques d’une rétinopathie pigmentaire. Cette image illustre une dégénérescence avancée des photorécepteurs, en particulier des bâtonnets, traduisant une atteinte périphérique progressive du champ visuel typique de cette pathologie.
2 Syndromes dits de « l’interface vitréomaculaire » : membranes épimaculaires et trous maculaires
En conditions « normales », le vitré postérieur se détache de la région maculaire autour de la cinquantaine. Au cours des syndromes de l’interface vitréomaculaire, c’est l’adhérence pathologique du vitré postérieur à la région maculaire qui va être à l’origine de différentes affections, principalement les membranes épimaculaires et les trous maculaires. Dans leur forme idiopathique, ces deux affections touchent plutôt les personnes âgées. Mais membranes et trous peuvent se rencontrer chez le sujet jeune, en particulier dans les suites de traumatisme, de déchirure rétinienne ou d’inflammation endo-oculaire sévère. Ce groupe d’affections est souvent retrouvé de manière unilatérale, mais l’atteinte bilatérale n’est pas rare.
a 154Membranes épi- ou prémaculaires
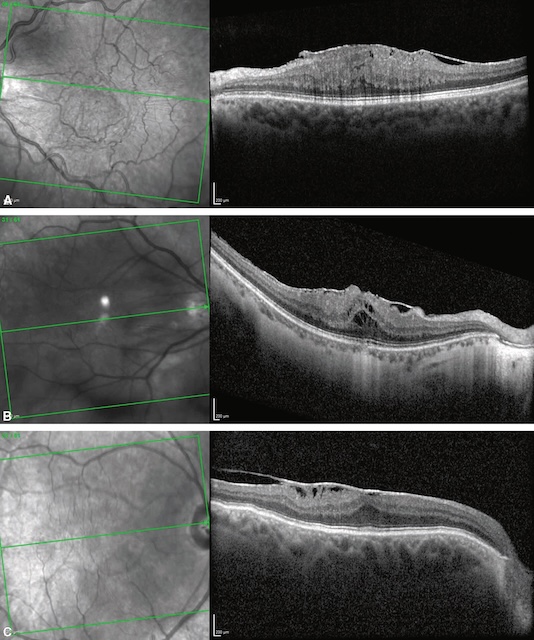
Dans ce cas, la séparation du vitré postérieur de la région maculaire va être associée à la prolifération d’un tissu fibreux à la surface de la macula que l’on appelle « membrane épi-maculaire » (fig. 7.4). Ces membranes peuvent rester paucisymptomatiques ou, au contraire, se rétracter et alors être responsables d’une baisse de vision et/ou de métamorphopsies. Au fond d’œil, elles prennent un aspect brillant (« reflet cellophane ») associé de manière variable à une distorsion du tissu rétinien adjacent et des vaisseaux. L’examen clé est l’OCT maculaire (voir fig. 7.4 et fig. 7.5A-C) qui confirme le diagnostic et objective l’augmentation secondaire de l’épaisseur rétinienne (reflet du degré de contraction de la membrane). Lorsque la baisse d’acuité visuelle associée est importante, la membrane peut être « pelée » chirurgicalement par voie de vitrectomie.

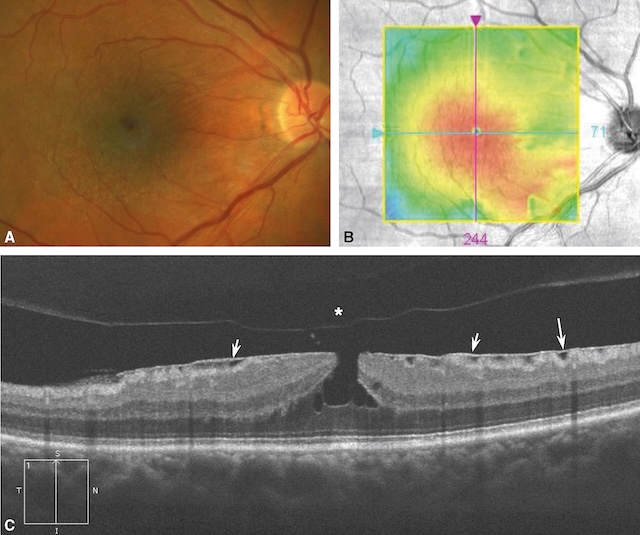
A. Reflet cellophane visible au fond d’œil avec plis et tractions des vaisseaux de petit calibre. B. Cartographie OCT avec épaississement maculaire (couleurs chaudes). C. Ligne hyperréflective visible à la surface de la rétine (flèches), responsable de la perte de l’aspect d’entonnoir fovéolaire « normal ». Noter le décollement du vitré postérieur en regard (astérisque).
La partie A montre une photographie couleur du fond d’œil centrée sur la macula, avec un reflet brillant, une légère distorsion rétinienne et un plissement en surface évoquant une membrane épirétinienne. La partie B présente une carte de l’épaisseur maculaire obtenue par tomographie en cohérence optique (OCT), avec un épaississement central de la rétine représenté par des teintes rouges et jaunes, traduisant une traction rétinienne. La partie C montre une coupe transversale maculaire en OCT illustrant une membrane épirétinienne hyperréflective provoquant une distorsion de la surface rétinienne et un épaississement. Des flèches indiquent les zones de plis rétiniens et de traction. L’astérisque marque une séparation partielle du vitré postérieur. Un carré en bas à gauche précise l’orientation de la zone maculaire analysée.
b Trous maculaires
Moins fréquents que les membranes épimaculaires, les trous maculaires correspondent à une perte de la continuité du tissu neurosensoriel dans la région maculaire par écartement des berges fovéolaires. Ils sont le plus souvent d’apparition rapide ou rapidement progressive avec 155baisse d’acuité visuelle et scotome central. Des métamorphopsies sont souvent associées. Là encore, l’examen clé reste l’OCT (fig. 7.6 et fig. 7.7) qui permet de confirmer le diagnostic, de mesurer la taille du trou et de poser l’indication chirurgicale (vitrectomie).

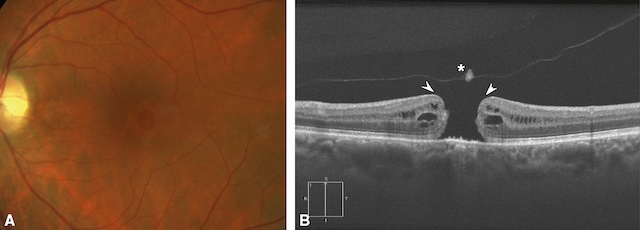
A. Aspect de trou maculaire visible au fond d’œil sous la forme d’une lésion orange foncé, arrondie, à bords nets. B. Écartement des berges maculaires (flèches), responsable de la perte de continuité de la rétine neurosensorielle. Noter le décollement du vitré postérieur en regard (astérisque).
Vue en deux parties montrant un trou maculaire. Partie A : Photographie couleur du fond d’œil d’un patient présentant une perte de continuité au niveau de la région maculaire. L’image révèle une zone centrale légèrement plus sombre dans la région fovéale, caractéristique d’un trou maculaire. Partie B : Image en tomographie en cohérence optique (OCT) transversale de la rétine montrant un trou maculaire complet. L’image met en évidence une interruption nette du tissu neurosensoriel au centre de la fovéa. On observe un écartement des berges fovéolaires (indiqué par deux flèches blanches) et une séparation du vitré postérieur (indiquée par un astérisque), ainsi qu’une hyperréflectivité intrarétinienne autour de la zone du trou.
3 Dégénérescence maculaire liée à l’âge
![]() Voir chapitre 15.
Voir chapitre 15.
La dégénérescence maculaire liée à l’âge (DMLA) peut entraîner une baisse d’acuité visuelle progressive.
4 œdèmes maculaires
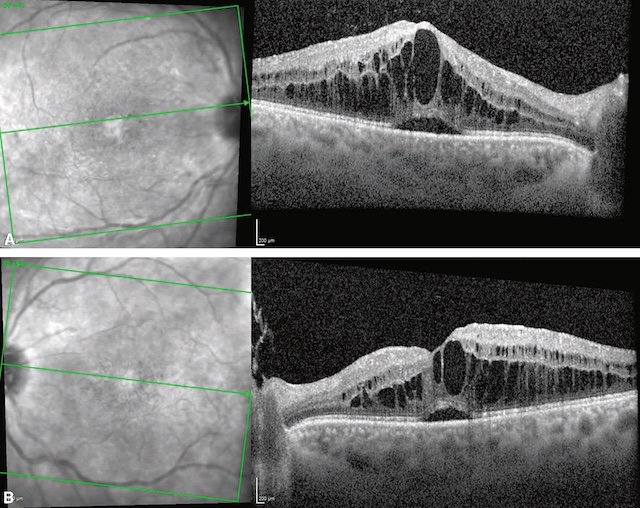
![]() L’œdème maculaire se caractérise par une augmentation de l’épaisseur maculaire, associée à une baisse d’acuité visuelle en général progressive (fig. 7.8 et fig. 7.9A,B). Des métamorphopsies sont présentes, d’apparition insidieuse si la cause est chronique, ou aiguë si l’apparition de l’œdème est brutale. Lorsque l’œdème maculaire est important, il prend un aspect d’œdème maculaire cystoïde, qui donne une image très typique « en pétales de fleur ». En OCT, les kystes intrarétiniens sont nettement individualisables et expliquent le syndrome maculaire généralement présent dans ce type d’atteinte.
L’œdème maculaire se caractérise par une augmentation de l’épaisseur maculaire, associée à une baisse d’acuité visuelle en général progressive (fig. 7.8 et fig. 7.9A,B). Des métamorphopsies sont présentes, d’apparition insidieuse si la cause est chronique, ou aiguë si l’apparition de l’œdème est brutale. Lorsque l’œdème maculaire est important, il prend un aspect d’œdème maculaire cystoïde, qui donne une image très typique « en pétales de fleur ». En OCT, les kystes intrarétiniens sont nettement individualisables et expliquent le syndrome maculaire généralement présent dans ce type d’atteinte.

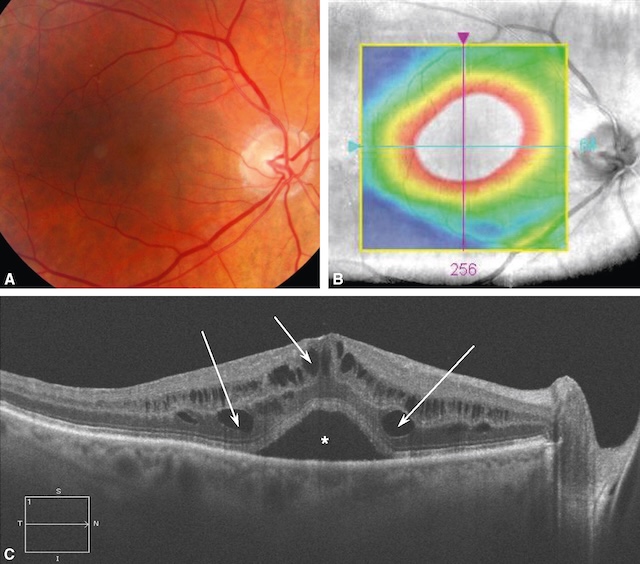
A. œdème maculaire diabétique dans sa forme diffuse. B. Cartographie OCT avec épaississement maculaire (couleurs chaudes jaune-rouge jusqu’au blanc). C. Logettes d’œdème intrarétinien visibles en OCT (flèches), responsable de la perte de l’aspect d’entonnoir fovéolaire « normal ». Noter un décollement séreux rétinien associé (astérisque).
Cette figure illustre un œdème maculaire diabétique à travers trois modalités d’imagerie. La partie A montre une photographie couleur du fond d’œil avec un épaississement maculaire central diffus. La partie B est une cartographie topographique rétinienne centrée sur la macula, en fausses couleurs, mettant en évidence une hyperépaisseur maculaire centrale en forme d’anneau concentrique, typique d’un œdème maculaire. La partie C correspond à une coupe OCT horizontale passant par la fovéa. Cette image montre des cavités kystiques intrarétiniennes hypo-réflectives situées dans les couches internes de la rétine, de part et d’autre d’un épaississement fovéal marqué (indiqué par des flèches). Une cavité centrale plus importante est marquée par un astérisque.
- • la maculopathie diabétique : l’œdème maculaire est la principale cause de malvoyance chez les diabétiques de type 2. L’équilibre de facteurs systémiques (hypertension artérielle) peut parfois suffire à traiter cet œdème, mais souvent des traitements par injections intra-vitréennes d’anti-VEGF ou de corticoïdes (dexaméthasone) sont nécessaires pour obtenir une amélioration fonctionnelle et anatomique (voir chapitre 21);
- • l’occlusion de la veine centrale de la rétine (OVCR) ou d’une de ses branches dans une forme œdémateuse. Là encore, les anti-VEGF et/ou les corticoïdes injectés dans le vitré permettent le plus souvent d’améliorer la fonction visuelle (voir chapitre 17);
- • la chirurgie de la cataracte : survenant dans environ 3 % des cas, quelques semaines après l’intervention chirurgicale (syndrome d’Irvine-Gass), l’œdème régresse dans les deux tiers des cas, mais dans un tiers des cas, soit 1 % des yeux opérés, l’évolution se fait vers un œdème maculaire chronique avec baisse d’acuité visuelle permanente en l’absence de traitement;
- • 156
 les uvéites : l’œdème maculaire est une des principales causes de baisse d’acuité visuelle permanente au cours des uvéites postérieures. Il peut aussi compliquer certaines uvéites antérieures lorsqu’elles sont chroniques. Le traitement de la cause de l’uvéite, les antiinflammatoires par voie systémique (corticoïdes, immunosuppresseurs, etc.) et/ou par injection intravitréenne (corticoïdes) en cas d’uvéite non infectieuse peuvent aider à améliorer le pronostic visuel;
les uvéites : l’œdème maculaire est une des principales causes de baisse d’acuité visuelle permanente au cours des uvéites postérieures. Il peut aussi compliquer certaines uvéites antérieures lorsqu’elles sont chroniques. Le traitement de la cause de l’uvéite, les antiinflammatoires par voie systémique (corticoïdes, immunosuppresseurs, etc.) et/ou par injection intravitréenne (corticoïdes) en cas d’uvéite non infectieuse peuvent aider à améliorer le pronostic visuel; - •
 les néovaisseaux choroïdiens et intrarétiniens : l’œdème maculaire entraîné par la perméabilité excessive des néovaisseaux peut entraîner des baisses d’acuité visuelle aiguës ou rapidement progressives. C’est une urgence thérapeutique et des injections intravitréennes d’anti-VEGF sont proposées rapidement afin de limiter les séquelles visuelles entraînées par ces néovaisseaux. La principale cause de néovaisseaux maculaire est la DMLA exsudative.
les néovaisseaux choroïdiens et intrarétiniens : l’œdème maculaire entraîné par la perméabilité excessive des néovaisseaux peut entraîner des baisses d’acuité visuelle aiguës ou rapidement progressives. C’est une urgence thérapeutique et des injections intravitréennes d’anti-VEGF sont proposées rapidement afin de limiter les séquelles visuelles entraînées par ces néovaisseaux. La principale cause de néovaisseaux maculaire est la DMLA exsudative.
5 Maculopathies toxiques
Les atteintes maculaires liées aux toxiques peuvent se manifester de différentes manières. Elles peuvent être d’apparition aiguë ou insidieuse. Les symptômes peuvent entrer dans le cadre 157d’un syndrome maculaire et peuvent associer baisse d’acuité visuelle, scotome central ou para-central, métamorphopsies et trouble de la vision des couleurs. L’atteinte est le plus souvent bilatérale.
L’interrogatoire est l’étape importante du diagnostic étiologique et recherchera particulièrement les potentielles prises de toxiques dans le cadre de conduites à risque, ou d’exposition professionnelle. Les prises médicamenteuses, leur durée et leur posologie devront aussi être relevées. Le traitement passe avant tout par l’arrêt de la substance provoquant la toxicité maculaire, mais cet arrêt doit être discuté dans certains cas avec le prescripteur initial lorsque aucune alternative thérapeutique ne peut être proposé.
a Maculopathie aux antipaludéens de synthèse
Un traitement au long cours par antipaludéens de synthèse (APS) peut entraîner l’apparition d’une rétinopathie toxique bilatérale potentiellement cécitante et irréversible. Le risque est supérieur avec la chloroquine (dose cumulée supérieure à 460 g) qu’avec l’hydroxychloroquine (dose cumulée supérieure à 1000 g), expliquant que la grande majorité des patients nécessitant la prise d’APS soit maintenant sous hydroxychloroquine. Le risque de toxicité rétinienne de l’hydroxychloroquine chez une personne ne présentant pas de pathologie rétinienne sous-jacente ni d’obésité (les APS ont tendance à être stockés dans la masse adipeuse) n’interviendrait pas avant 5 ans de prise continue. Le mécanisme de la toxicité des APS au niveau rétinien serait secondaire à l’accumulation de métabolites toxiques dans l’épithélium pigmentaire.
Les premiers signes de toxicité apparaissent dans la région juxtamaculaire où la densité pig-mentaire est particulièrement importante. L’atteinte toxique débute par une atteinte périfo-véolaire (qui épargne la fovéa), respectant ainsi l’acuité visuelle. L’atteinte débutante peut être détectée grâce à des examens complémentaires subjectifs nécessitant la collaboration du patient (champ visuel des 10° centraux retrouvant des scotomes juxtamaculaires et ERG multi-focal retrouvant une diminution des réponses périfovéolaires). Elle impose l’arrêt immédiat du traitement, car les mécanismes toxiques peuvent se poursuivre jusqu’à 6 mois après l’arrêt de la prise d’APS. En cas de poursuite du traitement, apparaît la maculopathie toxique aux APS en « œil de bœuf » visible au fond d’œil, en OCT et en angiographie (fig. 7.10). L’atteinte est alors irréversible.

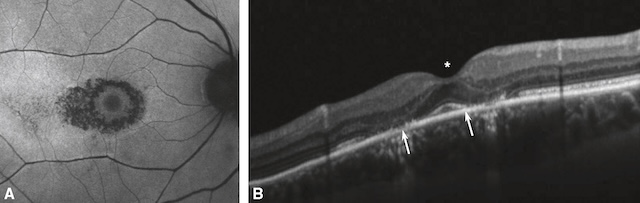
A. Aspect de dégénérescence de l’épithélium pigmentaire périfovéolaire sur le cliché en autofluorescence. La région centrofovéolaire est épargnée, réalisant ainsi un aspect en cocarde dit en « œil de bœuf ». B. Sur la coupe OCT correspondante, on observe une atrophie de l’épithélium pigmentaire et de la rétine externe dans les régions immédiatement périfovéolaires. La région centrofovéolaire reste encore préservée (astérisque).
La partie A montre une image en autofluorescence du fond d’œil avec un aspect typique de maculopathie en œil de bœuf : une zone centrale de relative préservation entourée d’un anneau circulaire d’atteinte de l’épithélium pigmentaire rétinien. La partie B correspond à une coupe en tomographie en cohérence optique (OCT) montrant des altérations anatomiques de la macula, avec amincissement et désorganisation des couches rétiniennes externes. Deux flèches blanches indiquent les zones de lésion de la couche des photorécepteurs, tandis qu’un astérisque signale un amincissement central.
Le bilan ophtalmologique avant la mise en place d’un traitement par APS (examen de référence) puis le suivi, au rythme adapté pour chaque patient et déterminé selon les recommandations internationales avec l’ophtalmologiste, permettent d’éviter ces complications dans la majorité des cas.
b 158Maculopathie aux inhibiteurs MEK
Les inhibiteurs MEK agissent sur des voies intracellulaires appelées voie MAPK qui peuvent être trop actives dans certains cancers solides. Ainsi, ces inhibiteurs sont de plus en plus utilisés en oncologie et notamment dans la prise en charge des mélanomes métastatiques. Les symptômes oculaires surviennent souvent de manière aiguë ou de manière rapidement progressive. ![]() L’atteinte rétinienne la plus fréquente se traduit par l’apparition spontanée de plusieurs petites « bulles » de décollement séreux rétiniens. Celles-ci sont généralement réversibles à l’arrêt du traitement voire lors d’une diminution de la posologie. Néanmoins, lorsque celles-ci n’entraînent pas une baisse d’acuité visuelle majeure, le rapport bénéfice/risque de la continuité du traitement anticancéreux doit être discuté entre l’ophtalmologiste et l’oncologue.
L’atteinte rétinienne la plus fréquente se traduit par l’apparition spontanée de plusieurs petites « bulles » de décollement séreux rétiniens. Celles-ci sont généralement réversibles à l’arrêt du traitement voire lors d’une diminution de la posologie. Néanmoins, lorsque celles-ci n’entraînent pas une baisse d’acuité visuelle majeure, le rapport bénéfice/risque de la continuité du traitement anticancéreux doit être discuté entre l’ophtalmologiste et l’oncologue. ![]() Une autre complication, moins fréquente mais plus grave peut survenir dans le cadre de la prise d’anti-MEK : l’occlusion de la veine centrale de la rétine.
Une autre complication, moins fréquente mais plus grave peut survenir dans le cadre de la prise d’anti-MEK : l’occlusion de la veine centrale de la rétine. ![]() Dans ce cas, l’arrêt du traitement est généralement proposé pour éviter la bilatéralisation des symptômes qui pourrait grever le pronostic visuel du patient.
Dans ce cas, l’arrêt du traitement est généralement proposé pour éviter la bilatéralisation des symptômes qui pourrait grever le pronostic visuel du patient.
c Maculopathie au nitrite d’alkyle (« poppers »)
![]() La maculopathie au nitrite d’alkyle ou « poppers » est une affection rare mais qui peut survenir de manière aiguë quelle que soit la chronicité de la prise de cette substance. Les nitrites d’alkyles étaient autrefois utilisés dans la prise en charge de l’angor du fait de leurs propriétés vasodilatatrices. Abandonnés ensuite au profit de la trinitrine, ils font maintenant l’objet d’un mésusage pour ses propriétés récréatives (euphorie, sensation ébrieuse, stimulation sexuelle).
La maculopathie au nitrite d’alkyle ou « poppers » est une affection rare mais qui peut survenir de manière aiguë quelle que soit la chronicité de la prise de cette substance. Les nitrites d’alkyles étaient autrefois utilisés dans la prise en charge de l’angor du fait de leurs propriétés vasodilatatrices. Abandonnés ensuite au profit de la trinitrine, ils font maintenant l’objet d’un mésusage pour ses propriétés récréatives (euphorie, sensation ébrieuse, stimulation sexuelle).
![]() La présentation clinique est caractéristique et montre dans les heures ou les jours suivant l’inhalation de la substance une baisse d’acuité visuelle avec phosphènes et microscotome central. L’examen du fond d’œil peut montrer de petites taches jaunâtres maculaires, mais peut être normal. L’OCT montre une atteinte des photorécepteurs maculaires. Il n’existe pas de traitement spécifique et l’évolution se fait généralement vers une disparition des symptômes en quelques jours. Il peut persister des séquelles visuelles dans certains cas, entraînant une baisse d’acuité visuelle et des microscotomes irréversibles.
La présentation clinique est caractéristique et montre dans les heures ou les jours suivant l’inhalation de la substance une baisse d’acuité visuelle avec phosphènes et microscotome central. L’examen du fond d’œil peut montrer de petites taches jaunâtres maculaires, mais peut être normal. L’OCT montre une atteinte des photorécepteurs maculaires. Il n’existe pas de traitement spécifique et l’évolution se fait généralement vers une disparition des symptômes en quelques jours. Il peut persister des séquelles visuelles dans certains cas, entraînant une baisse d’acuité visuelle et des microscotomes irréversibles.
V Altérations du champ visuel
![]() Les altérations du champ visuel traduisent une altération de la vision périphérique. Elles peuvent s’accompagner ou non d’une baisse de l’acuité visuelle si l’atteinte campimétrique atteint la région centrale. Ces anomalies du champ visuel peuvent être présentes lors de certaines affections rétiniennes ou en cas d’atteinte des voies optiques (du nerf optique au cortex occipital).
Les altérations du champ visuel traduisent une altération de la vision périphérique. Elles peuvent s’accompagner ou non d’une baisse de l’acuité visuelle si l’atteinte campimétrique atteint la région centrale. Ces anomalies du champ visuel peuvent être présentes lors de certaines affections rétiniennes ou en cas d’atteinte des voies optiques (du nerf optique au cortex occipital).
A Anomalies du champ visuel au cours d’affections rétiniennes
- • soit de scotomes centraux ou paracentraux en cas d’atteinte de la rétine centrale respectant la périphérie. Un scotome central traduit l’atteinte du point de fixation et s’accompagne toujours d’une baisse d’acuité visuelle sévère (par exemple DMLA évoluée);
- • soit de déficits périphériques du champ visuel lors d’atteintes rétiniennes siégeant ou débutant en périphérie (par exemple décollement de la rétine rhegmatogène, rétinopathie pigmentaire).
B Atteinte du champ visuel par atteinte des voies optiques
Le relevé du champ visuel est dans ce cas essentiel. En fonction des résultats obtenus, une localisation assez précise du lieu de la (des) lésion(s) est possible et permettra de cibler efficacement les examens complémentaires ultérieurs (fig. 7.11). Une atteinte uniquement unilatérale signera une localisation 159de la lésion sur l’un des deux nerfs optiques; une atteinte bilatérale traduira généralement une localisation lésionnelle se situant sur le chiasma optique ou au-delà sur les voies optiques. La réalisation de PEV est souvent requise pour confirmer l’atteinte des voies visuelles au-delà de la rétine, et une IRM cérébrale ciblant la voie visuelle peut être utile pour avancer dans la démarche diagnostique.

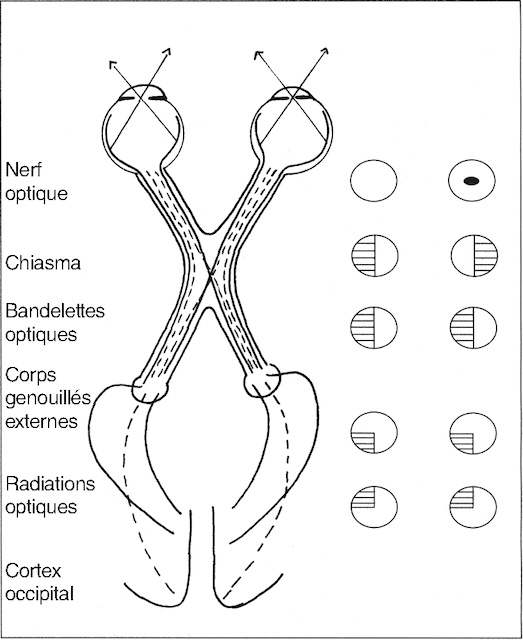
Nerf optique : scotome central. Chiasma : hémianopsie bitemporale. Bandelettes optiques : hémianopsie latérale homonyme. Radiations optiques : quadranopsie latérale homonyme.
Schéma représentant les différentes structures des voies optiques de haut en bas : nerf optique, chiasma optique, bandelettes optiques, corps génouillés externes, radiations optiques, cortex occipital. Des cercles illustrant les altérations du champ visuel associées à une lésion de chaque niveau se trouvent à droite de chaque structure. Ce schéma permet une corrélation topographique entre les zones atteintes et les déficits visuels observés.
1 Atteintes du nerf optique
L’atteinte totale d’un nerf optique est responsable d’une cécité unilatérale et se voit parfois lors de traumatismes (fig. 7.12A) ou d’atteinte tumorale du nerf optique.


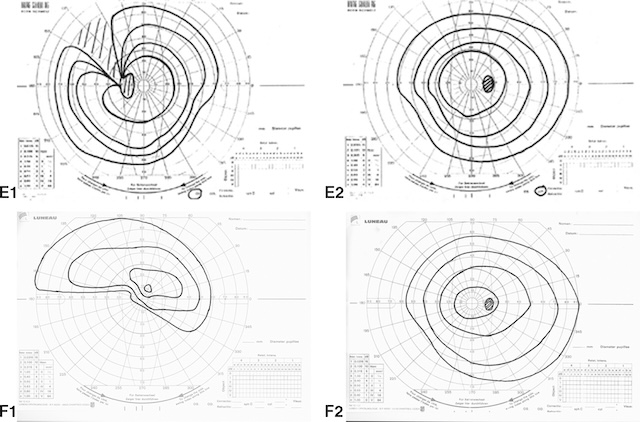
A. Cécité unilatérale (par exemple traumatisme œil gauche). B1, B2. Scotome central unilatéral gauche (par exemple sclérose en plaques [SEP]). C1, C2. Scotome cœcocentral unilatéral gauche (par exemple SEP). D1, D2. Scotome cœcocentral bilatéral (par exemple neuropathie optique éthylique).
E1, E2. Déficit fasciculaire gauche (par exemple glaucome à angle ouvert). F1, F2. Déficit fasciculaire altitudinal inférieur gauche (par exemple neuropathie optique ischémique antérieure aiguë). L’atteinte d’un faisceau de fibres au niveau de la papille est responsable d’un déficit fasciculaire; cela se traduit par un déficit isoptérique relié à la tache aveugle. Lors d’une atteinte ischémique de la papille, il prend typiquement l’aspect d’un déficit altitudinal (en J) à limite horizontale.
Série de cartes périmétriques (Parties A à F2) illustrant différents types d’altérations du champ visuel observés dans les neuropathies optiques. Partie A : Cécité unilatérale complète correspondant à une atteinte totale du nerf optique. Parties B1 et B2 : Scotomes centraux unilatéraux, traduisant une atteinte des fibres maculaires. Parties C1 et C2 : Scotomes cæcocentraux bilatéraux englobant la tache aveugle et le point de fixation, caractéristiques des neuropathies optiques toxiques ou métaboliques. Parties D1 et D2 : Autres formes de scotomes cæcocentraux bilatéraux. Partie E1 : Déficit fasciculaire rattaché à la tache aveugle, typique d’un glaucome à angle ouvert. Partie E2 : Anomalie isoptérique avec atteinte arciforme périphérique. Parties F1 et F2 : Déficits altitudinaux à limite horizontale, caractéristiques d’une neuropathie optique ischémique antérieure. Chaque carte représente la sensibilité visuelle à l’aide de cercles concentriques ; les zones denses indiquent des pertes de sensibilité dans le champ visuel.
Une atteinte des fibres optiques à point de départ maculaire réalise :
L’atteinte d’un faisceau de fibres au niveau de la papille est responsable d’un déficit fascicu-laire (fig. 7.12E); il se traduit par un déficit isoptérique relié à la tache aveugle. On l’observe notamment lors du glaucome à angle ouvert.
L’atteinte prend typiquement l’aspect d’un déficit altitudinal (fig. 7.12F), à limite horizontale dans la neuropathie optique ischémique antérieure.
a Névrites optiques retrobulbäres de la sclérose en plaques
Voir chapitre 19.
L’atteinte est souvent rapidement progressive et peut provoquer une baisse d’acuité visuelle de profondeur variable avec un fond d’œil généralement normal. Celle-ci est liée à l’apparition d’un scotome le plus souvent central ou cœcocentral. L’atteinte visuelle est souvent accompagnée d’une douleur rétro-orbitaire augmentant à la mobilisation des globes oculaires. La névrite optique rétrobulbaire doit faire rechercher en premier lieu la sclérose en plaques qui en est sa principale étiologie, notamment chez la patiente jeune. Dans ce cas, la récupération de la fonction visuelle est souvent complète après plusieurs semaines.
b 160Neuropathies optiques ischémiques antérieures
Voir chapitre 20.
L’atteinte est brutale et provoque le plus souvent un scotome altitudinal de localisation inférieure, mais peut aussi donner d’autres atteintes campimétriques. L’artérite à cellules géantes est à rechercher en priorité devant cette atteinte ischémique du nerf optique afin de proposer un traitement par corticoïdes et d’éviter la bilatéralisation de l’atteinte.
c Neuropathies optiques toxiques et métaboliques
![]() Ces neuropathies ont en commun de se manifester par une atteinte bilatérale et progressive. Elles sont dominées par quatre causes :
Ces neuropathies ont en commun de se manifester par une atteinte bilatérale et progressive. Elles sont dominées par quatre causes :
- • neuropathie optique éthylique : favorisée par le tabagisme associé; on parle alors volontiers de neuropathie optique alcoolo-tabagique. Typiquement, le champ visuel objective un scotome cœcocentral bilatéral. En l’absence de sevrage avec supplémentation vitaminique, elle aboutit à la constitution d’une atrophie optique;
- • neuropathies optiques médicamenteuses : observées principalement au cours de traitements antituberculeux (éthambutol et isoniazide). Elles peuvent aboutir à une baisse d’acuité visuelle définitive, imposant une surveillance régulière systématique des patients traités par l’examen du champ visuel et la vision des couleurs, OCT papille (avant traitement, J21 et M2, puis tous les 2 mois si prolongation du traitement), ces neuropathies optiques se révélant précocement par une dyschromatopsie d’axe rouge-vert;
- •
 neuropathies optiques professionnelles (par exemple plomb);
neuropathies optiques professionnelles (par exemple plomb); - • neuropathies optiques métaboliques : notamment au cours du diabète.
d 161Neuropathies optiques tumorales
- • les tumeurs intra-orbitaires qui, quelle qu’en soit la nature, peuvent être responsables d’une compression du nerf optique. Il peut s’agir de tumeurs développées aux dépens du nerf optique (gliome) ou de ses gaines (méningiome). Elles se traduisent le plus souvent par une atrophie optique associée à une exophtalmie;
- • les tumeurs de l’étage antérieur du crâne (méningiome du sphénoïde, etc.) qui peuvent comprimer les voies optiques et ainsi donner des atteintes du champ visuel bilatérales.
2 162Lésions du chiasma optique
Au niveau du chiasma optique, il existe une décussation des axones des cellules ganglionnaires. L’organisation de l’information visuelle passe d’une organisation monoculaire à une organisation hémiopique (par hémichamp). Les fibres véhiculant l’information de l’hémichamp nasal de chaque œil croisent la ligne médiane et fusionnent avec celle de l’œil controlatéral dans le but de permettre une vision binoculaire utile avec perception du relief.
La compression des voies optiques au niveau du chiasma induit de ce fait un aspect très particulier au niveau du champ visuel appelé « syndrome chiasmatique » qui, dans sa forme typique, se traduit par une hémianopsie bitemporale (fig. 7.13B1, B2), c’est-à-dire un déficit dans les hémichamps temporaux (correspondant à l’atteinte des fibres nasales qui décussent au niveau du chiasma). Parfois, la compression est partielle (notamment dans les stades débutants) et on observe une quadranopsie bitemporale (fig. 7.13A1, A2). Les fibres nasales inférieures décussent à la partie antérieure du chiasma, les fibres nasales supérieures à la partie postérieure et donc, en fonction de la topographie de l’atteinte, la quadranopsie peut être supérieure ou inférieure (plus fréquemment supérieure).

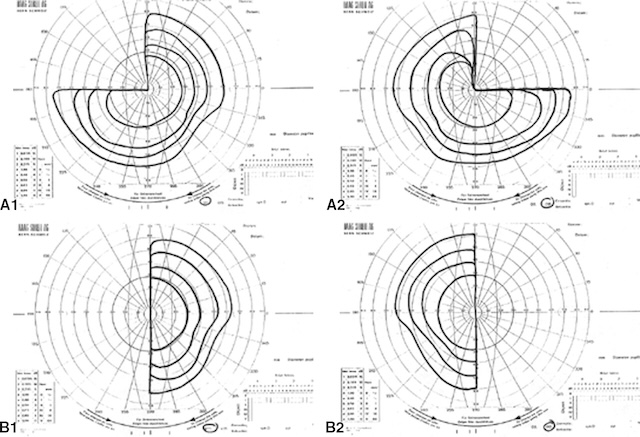
A1, A2. Quadranopsie bitemporale supérieure. B1, B2. Hémianopsie bitemporale.
Résultats de périmétrie montrant une quadranopsie bitemporale supérieure dans le cadre d’un syndrome chiasmatique débutant. Partie A1 : carte périmétrique de l’œil gauche présentant une perte de sensibilité dans le quadrant supérieur temporal. Partie A2 : carte périmétrique de l’œil droit montrant une atteinte similaire dans le quadrant supérieur temporal. Ces atteintes correspondent à une compression partielle du chiasma optique affectant les fibres nasales inférieures croisées. Résultats de périmétrie illustrant une hémianopsie bitemporale complète typique d’un syndrome chiasmatique évolué. Partie B1 : carte périmétrique de l’œil gauche montrant une perte complète dans le champ temporal. Partie B2 : carte périmétrique de l’œil droit avec une perte équivalente dans le champ temporal.
163Sur le plan étiologique, la principale cause de syndrome chiasmatique est représentée par les adénomes de l’hypophyse. Le syndrome chiasmatique est alors d’installation souvent progressive, débutant par une quadranopsie bitemporale supérieure. D’autres affections peuvent être responsables d’un syndrome chiasmatique, parfois moins typique en fonction de la localisation de l’atteinte du chiasma :
3 Lésions rétrochiasmatiques
L’atteinte de la voie optique est présente au-delà de la région chiasmatique, donc après la décussation des fibres nasales. Cela se traduit par un déficit sensoriel dans un hémichamp, droit ou gauche (le même des deux côtés), appelé hémianopsie latérale homonyme, le déficit se situant du côté opposé à la lésion (fig. 7.14). Une atteinte des radiations optiques, où fibres supérieures et inférieures cheminent dans deux faisceaux nettement séparés, se traduira plus volontiers par une quadranopsie latérale homonyme (fig. 7.15), le plus souvent supérieure.


A1, A2. Hémianopsie latérale homonyme gauche (atteinte des voies optiques rétrochiasmatiques droites). B1, B2. Hémianopsie latérale homonyme droite (atteinte des voies optiques rétrochiasmatiques gauches).
Résultats de périmétries illustrant des hémianopsies latérales homonymes complètes à droite et à gauche, traduisant une atteinte rétrochiasmatique des voies optiques. Partie A1 : carte périmétrique de l’œil gauche montrant une perte complète de sensibilité dans l’hémichamp nasal. Partie A2 : carte périmétrique de l’œil droit montrant une perte complète de l’hémichamp temporal. Ces deux déficits sont symétriques et correspondent à une hémianopsie latérale homonyme gauche, typique d’une lésion située à droite de la voie rétrochiasmatique. Partie B1 : périmétrie de l’œil gauche avec une perte complète de l’hémichamp temporal. Partie B2 : périmétrie de l’œil droit avec perte de l’hémichamp nasal. Ensemble, les Parties B1 et B2 montrent une hémianopsie latérale homonyme droite, compatible avec une atteinte rétrochiasmatique gauche.

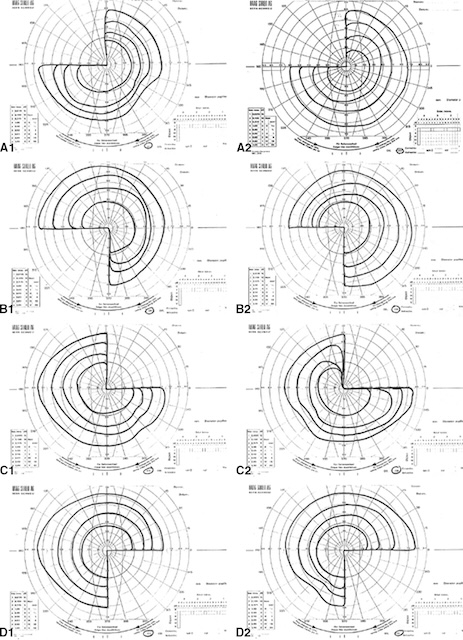
A1, A2. Quadranopsie latérale homonyme supérieure gauche (atteinte du faisceau inférieur des radiations optiques droites). B1, B2. Quadranopsie latérale homonyme inférieure gauche (atteinte du faisceau supérieur des radiations optiques droites). C1, C2. Quadranopsie latérale homonyme supérieure droite (atteinte du faisceau inférieur des radiations optiques gauches). D1, D2. Quadranopsie latérale homonyme inférieure droite (atteinte du faisceau supérieur des radiations optiques gauches).
Cartes de périmétrie illustrant des quadranopsies latérales homonymes. De haut en bas et de gauche à droite : Partie A1 et A2 : périmétries des deux yeux montrant une quadranopsie latérale homonyme supérieure droite, compatible avec une atteinte des radiations optiques gauches, notamment dans la région temporale. Partie B1 et B2 : cartes présentant une quadranopsie latérale homonyme inférieure droite, évoquant une lésion des radiations optiques gauches supérieures, potentiellement au niveau du lobe pariétal. Partie C1 et C2 : périmétries indiquant une quadranopsie latérale homonyme supérieure gauche, en faveur d’une atteinte des radiations optiques droites inférieures. Partie D1 et D2 : périmétries montrant une quadranopsie latérale homonyme inférieure gauche, traduisant une atteinte probable des radiations optiques droites supérieures.
Sur le plan étiologique, on retrouve principalement les trois causes suivantes :
- • vasculaire (accident vasculaire cérébral, hématome compressif) : hémianopsie ou quadra-nopsie latérale homonyme d’installation brutale;
- • 164165tumorale : hémianopsie ou quadranopsie latérale homonyme d’installation progressive;
- • traumatique : hémianopsie ou quadranopsie latérale homonyme contemporaine du traumatisme.
4 Cécité corticale
On désigne sous ce terme un tableau clinique particulier secondaire à une atteinte des deux lobes occipitaux, le plus souvent par accident vasculaire cérébral dans le territoire vertébro-basilaire. Elle réalise une cécité bilatérale brutale, associée à des éléments évocateurs :
- • examen ophtalmologique normal, notamment examen du fond d’œil;
- • conservation du réflexe photomoteur (+++) traduisant le fonctionnement du « capteur sensoriel », c’est-à-dire la rétine neurosensorielle, mais l’absence d’interprétation correcte du signal au niveau cortical;
- • désorientation temporospatiale, hallucinations visuelles et anosognosie = méconnaissance de sa cécité par le patient, très caractéristique (+++), confirmant la nature centrale de l’affection.
 Compléments en ligne
Compléments en ligne
Une patiente de 83 ans présente une baisse d’acuité visuelle progressive bilatérale et indolore à 6/10es P2 aux deux yeux. Quel(s) est (sont) le(s) diagnostic(s) compatible(s) avec ces symptômes ?
Une patiente de 85 ans vous est adressée pour investigation d’une baisse d’acuité visuelle progressive bilatérale, ayant été découverte suite à une chute au domicile. Son œil est blanc et indolore, son acuité visuelle est chiffrée à 2/10es Parinaud 8 aux deux yeux. Quel(s) est (sont) le(s) diagnostic(s) possible(s) ?
Un patient de 62 ans présente une amputation de l’hémichamp droit de manière brutale et qui persiste lors de l’occlusion d’un œil ou l’autre. L’examen ophtalmologique est strictement normal. Quel(s) est (sont) le(s) diagnostic(s) possible(s) ?
Parmi les étiologies suivantes, laquelle (lesquelles) peut(vent) provoquer un syndrome maculaire ?
Parmi les étiologies suivantes, laquelle (lesquelles) ne peut (peuvent) pas être associée(s) à un œdème maculaire ?
 Réponses
Réponses
Commentaires : La DMLA néovasculaire donne une baisse d’acuité visuelle brutale. La DMLA atrophique donne une baisse d’acuité visuelle plus profonde associée à une baisse d’acuité visuelle de près. Le glaucome chronique ne donne pas de baisse d’acuité visuelle, mais un rétrécissement du champ visuel. L’occlusion de la veine centrale de la rétine (OVCR) est rarement bilatérale, et la baisse d’acuité visuelle est brutale et plus importante.
Commentaires : Le glaucome ne donne pas de baisse d’acuité visuelle, mais une réduction du champ visuel. La DMLA précoce/intermédiaire ne donne qu’une baisse d’acuité visuelle très modérée. La DMLA néovasculaire donne une baisse d’acuité visuelle aiguë, et est rarement bilatérale d’emblée.
Commentaires : L’atteinte chiasmatique peut donner une hémianopsie bitemporale qui se traduit par une amputation des deux hémichamps temporaux.
167Commentaires : Le syndrome maculaire est provoqué par des pathologies avec atteinte maculaire.
Commentaires : La maladie de Stargardt est associée à une atrophie maculaire et non un œdème.
 Compléments en ligne
Compléments en ligne
Des compléments numériques sont associés à ce chapitre. Ils sont indiqués dans le texte par un picto. Pour voir ces compléments, connectez-vous sur http://www.em-consulte.com/ e-complements/478662 et suivez les instructions.

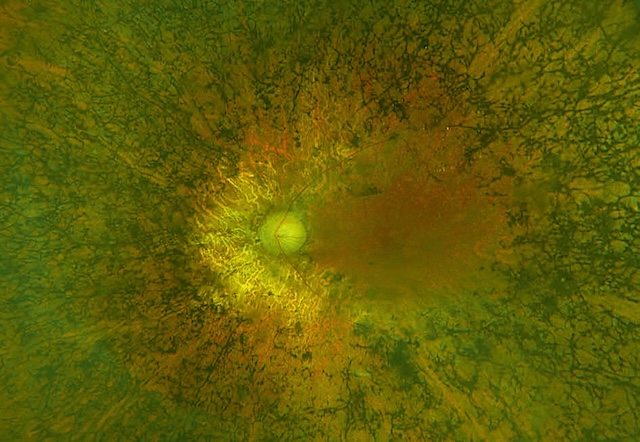
Photographie couleur du fond d’œil illustrant une rétinopathie pigmentaire avancée. La papille optique, bien définie en position centrale, est entourée d’un réseau dense de migrations pigmentaires en périphérie rétinienne, sous forme de dépôts noirs évoquant un motif en « pseudo-ostéoblastes ». Ce tableau est typique d’une dégénérescence des photorécepteurs, touchant principalement les bâtonnets, et s’associe cliniquement à une héméralopie et un rétrécissement progressif du champ visuel.

Parties A à C. Série d’images obtenues par tomographie en cohérence optique (OCT) illustrant une membrane épimaculaire. Chaque partie comporte à gauche une image du fond d’œil en infrarouge avec des lignes de balayage vertes superposées, et à droite, la coupe transversale OCT correspondante. La partie A montre une surface épirétinienne épaissie et plissée avec des replis rétiniens. La partie B révèle une déformation plus marquée du contour maculaire avec distorsion et possibles modifications sous-rétiniennes. La partie C présente une membrane plus fine avec une traction limitée aux couches rétiniennes internes.

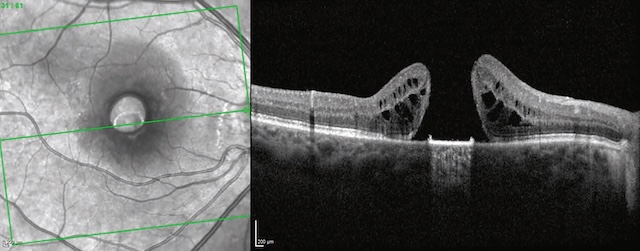
Image en deux parties montrant un trou maculaire observé par tomographie en cohérence optique (OCT). Partie A, à gauche : image infrarouge en réflectance de la rétine avec superposition de deux lignes de balayage vertes encadrant un trou rond et bien défini au niveau de la macula. Partie B, à droite : coupe transversale OCT de la rétine correspondant à la zone balisée, montrant une perte nette de la continuité du tissu neurosensoriel fovéolaire. On observe un écartement symétrique des bords rétiniens avec présence de kystes intrarétiniens bilatéraux.

Deux images en tomographie en cohérence optique (OCT) illustrent un œdème maculaire diabétique. Dans chaque ensemble, l'image de gauche montre une photographie infrarouge de la rétine avec repérage des coupes OCT par des lignes vertes. Les images de droite représentent les coupes OCT correspondantes. Sur les coupes transversales, on observe une augmentation de l'épaisseur rétinienne avec de multiples espaces kystiques intrarétiniens bien délimités.
